FFFを用いた肺がんのVMAT SRT
中川 恵一(東京大学医学部附属病院放射線科准教授)
日本放射線腫瘍学会第27回学術大会ランチョンセミナー
日本放射線腫瘍学会第27回学術大会が2014年12月11日(木)〜13日(土)の3日間,パシフィコ横浜(横浜市)にて開催された。12日(金)に行われたエレクタ株式会社共催のランチョンセミナー8では,国立がん研究センター中央病院放射線治療科科長の伊丹 純氏が座長を務め,東京大学医学部附属病院放射線科准教授の中川恵一氏が,「FFFを用いた肺がんのVMAT SRT」をテーマに講演を行った。
2015-3-1

当院では,長年にわたり画像誘導放射線治療(以下,IGRT)の臨床研究を行ってきたが,現在はエレクタ社製の「Elekta Synergy」を使用し,Flattening-Filter Free(FFF:平坦化フィルタなし)での肺がんの強度変調回転放射線治療による定位放射線治療(以下,VMAT-SRT)に取り組んでいる。VMAT-SRTでは,四次元コーンビームCT(以下,4D-CBCT)によるレジストレーションを行うことで,肺などの動きのある臓器においてもきわめて高精度な照射が短時間で可能となるが,FFFを組み合わせることにより,さらなる治療時間の短縮化が図られる。
本講演では,肺がんにおけるFFF VMAT-SRTの有用性について報告するが,その前にまず当院におけるIGRTの歴史的な変遷について述べる。
東大病院におけるIGRTの変遷
当院では1985年,世界で初めてCTとリニアックの寝台を共有する同室設置型CT(以下,In-room kV CT)の使用を開始した。当時のリニアックには,世界初のコンピュータ制御された2cm厚のmulti-leaf collimator(以下,MLC)が搭載されており,寝台の移動とMLCの動きを同期させることで,非常に広い範囲へのスムーズな照射野が実現可能となった。また,2台目の装置では線量率の制御も行っており,厚みや形状が一定でないものに対して線量を補正して均一に照射することが可能であった。
1990年頃にはMegavoltage CT(以下,MV CT)を用いて患者位置を補正し,原体照射を行うようになったが,その際,治療計画用CTで撮影した画像と位置合わせ前のMV CT画像をPhotoshop上でレジストレーションし,目視で画像のズレを補正していた。また,肺がんのSRTでは肺の動きが問題となるため,当院では動きによるMV CTへの影響を検証し,照射マージンを設定していた。
2007年には,In-room kV CTとMV CTの融合とも考えられる強度変調放射線治療(以下,IMRT)とIGRTを実施可能なElekta Synergyを日本で初めて導入した。導入後,最初に考えたことは,原体照射中あるいは回転照射中にCBCTを撮影すれば,治療計画画像とのレジストレーションができるのではないか,ということだった。実際の症例で,治療前,治療中,治療後のCBCT画像の位置ズレを検証し,有用性を確認できた。
一方,ターゲットへの線量集中性の向上と危険臓器の線量低減が同時に図れる照射法として高橋信次先生が提唱された打ち抜き原体照射があるが,計画標的体積(以下,PTV)内に線量分布の不均一が生じることが問題となる。そこで,イタリアのPellegriniらが考案した,IMRT用治療計画システム「ERGO++」(エレクタ社製)を用いて原体照射および
打ち抜き原体照射に線量率変調を加える“VMAT by ERGO++”とも呼ぶべき方法を取り入れ,打ち抜き原体照射の線量分布の最適化を図った。
さらに,2008年には,われわれが世界で初めてVMATの治療中にCBCT撮影を行ったが,治療時間は100秒,CBCTを加えても200秒であった。この世界初のVMAT中のCBCTにより得られた画像は,2009年のRadiotherapy and Oncology誌(通称:グリーンジャーナル,Vol.90, No.3)の表紙を飾った。
4D-CBCTの登場
肺がんのSRTでは,腫瘍の呼吸性移動が問題となる。そこで,CBCTの四次元化(4D-CBCT)が考案された(図1)。ワークステーション上で投影画像を横隔膜のレベルで呼吸位相ごとに10位相(図1では模式的に4位相)に分けて重ね合わせることで各位相の三次元画像を得,さらに,それらをムービー表示することで4D-CBCTが得られる。

図1 Elekta Synergyにおける4D-CBCTの原理
エレクタ社が上記の方法でCBCTの四次元化を図ろうとしていた頃,われわれも独自に四次元化の研究に取り組んでいた。隣接する投影画像上の肺腫瘍画像の相互相関を計算することにより,CBCTデータを四次元化した。本法を10名の患者に対して適用したところ,すべての症例において内的標的体積(以下,ITV)に5mmのマージンをつけたPTVの中に治療中の腫瘍の移動範囲が収まっていることが確認できた1)。
その後,エレクタ社は,前述の4D-CBCTを基に腫瘍の位置や呼吸性移動を確認し,治療寝台位置の調整を行うことで正確な放射線治療を可能とするソフトウエア“XVI Symmetry”(以下,Symmetry)を商品化した。治療計画時の3D-CT画像におけるITV,PTVと治療直前の4D-CBCTとをSymmetryによりレジストレーションし,画像のズレを目視で補正している(図2)。
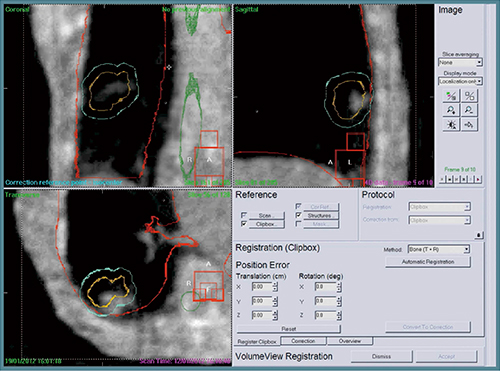
図2 3D-CT画像と4D-CBCTのレジストレーション
4D-CBCTを用いたVMAT-SRTによる治療の実際
当院の治療の流れを図3に示す。治療計画においては,まず呼吸抑制を行い,治療計画用CTで10位相の4D-CTを撮影し,それぞれについて肉眼的腫瘍体積(以下,GTV)の輪郭をとり,それを基にITVを作成する。さらに,5mmのマージンを加えてPTVとする。線量処方はD95とし,55Gy/4分割(1回線量は13.75Gy)で照射を行う。線量計算は最大呼気位相のCT上で行っており,使用X線エネルギーは6MVとしている。次に,治療直前に毎回必ず10位相の4D-CBCTを撮影し,Symmetryで治療計画用4D-CTとのレジストレーションを行う。そして,治療中のCBCTを撮影し,自作ソフトウエアにて再構成した4D-CBCTを治療計画システムに転送して位相ごとに腫瘍の局在,ITV,PTVとの関係を確認し,適切に腫瘍に照射されているかを検証する。これにより,複数日にわたり治療中の腫瘍の位置がPTV内に収まっていることが確認可能であり(図4),きわめて有用である。
また,4Dレジストレーション時の位置ズレの補正は,Symmetryの“1-click 4D-registration”機能によりほぼ自動的に可能であり,実際に精度良く一致した画像が得られている(図5)。
VMAT-SRT中の4D-CBCTについて,当院の37日分(370位相)の画像を検討した2)。治療中の頭尾方向の移動距離は 平均5.1mmであり,治療計画時のITVとの一致率は84.2%であった。1症例についてのみ,計2日においてPTV外への腫瘍移動が見られたが,それ 以外はすべて治療計画時のPTV内に収まっていた。一方,治療中の4D-CBCTによる被ばく線量は30mSv以下で,FFFを用いた場合は治療時間が短 くなることもあり10mSv以下に低減可能だった。また,治療前の4D-CBCTによる被ばく線量は約30mSvであるが,3D-CBCTであれば約 15mSvに低減できる。
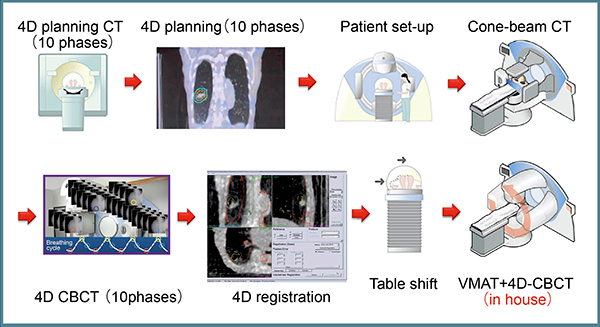
図3 当院におけるVMAT-SRTのワークフロー
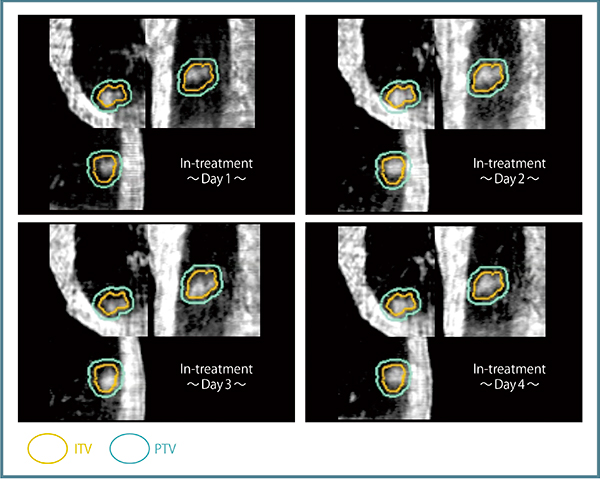
図4 VMAT中の4D-CBCTによる腫瘍の移動範囲の確認
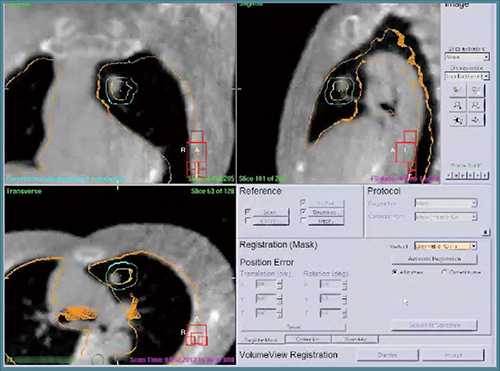
図5 Symmetryの1-click 4D-registration
Flattening-Filter Free(FFF)によるVMAT-SRT
リニアックでは,線量プロファイルを平坦化するためにFlattening-Filter(以下,FF)を使用しているが,現在のように線量分布を最適化する治療が中心になってくると,線量プロファイルが平坦である必要はない。そこで,FFを外すと中心付近が突出した線量プロファイルとなり,高線量率となる。
FFの有無による肺のVMAT-SRTにおける線量分布を比較した結果,違いはほとんど見られず,しかも,VMAT-SRT中の4D-CBCT(以下,FFF VMAT-SRT+4D-CBCT)にかかる時間は,FFありでは202.7秒だったのに対し,FFなしでは約90秒にまで短縮できた3)。
当院では現在,FFF VMAT-SRT+4D-CBCTの臨床応用を開始しており,5症例(2014年12月8日現在)に対して施行した。220°回転にて95秒で13.75GyのFFF VMAT-SRT+4D-CBCTが施行できており,治療中の腫瘍の動きもPTV内にほぼ収まっていることを確認している(図6)。
治療計画は,「Monaco」(エレクタ社製)と「Pinnacle3」(フィリップス社製)の“SmartArc”を用いて行っている。図7にFFF VMAT-SRTのプロトコールを示す。実際の症例における治療中(1日目と4日目)の確認画像では,非常に安定した再現性が得られていることがわかる(図8)。図9は,Pinnacle3のSmartArcを用いた場合のプロトコールで,内容はほぼMonacoと同様である。なお,治療時間が短くなると投影画像数が減少するため,画像が粗くなるというトレードオフがある。
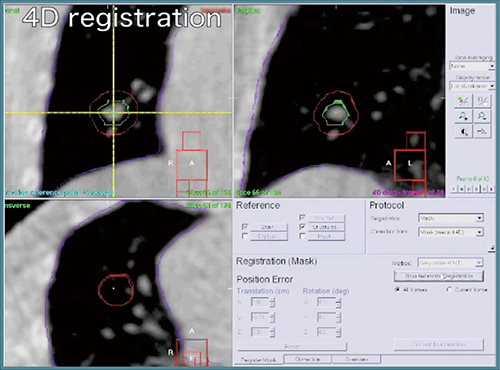
図6 FFF VMAT-SRT中の4D-CBCT画像
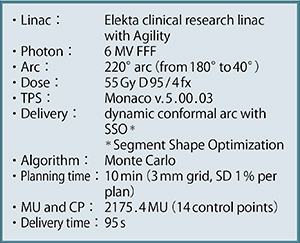
図7 Monacoを用いた場合のFFF VMAT-SRTプロトコール
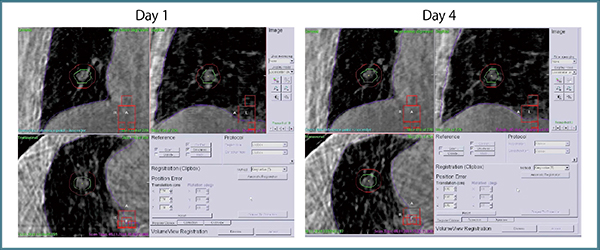
図8 Monaco用プロトコールでのFFF VMAT-SRT中の4D-CBCT画像 Delivery time:95s
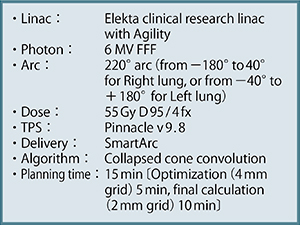
図9 Pinnacle3のSmartArcを用いた場合のFFF VMAT-SRTプロトコール
FFF VMAT-SRT+4D-CBCTの今後の展開
VMAT-SRT+4D-CBCTは現在,FFありでも200秒程度で治療を終えることができるため,FFF VMAT-SRT+4D-CBCTは,本質的にこの方法でなければ治療できない症例にのみ適応するべきと考えている。その1つが,呼吸抑制を行っても動きが抑制できない患者への息止め照射である。その際,FFFにて線量率が上がることが非常に有利となる。
また,現在,CBCTを作成する際の投影画像は,画面上にはすぐに表示されるが出力には時間がかかる。そのため,投影画像として,フラットパネルで撮影する最初の二次元画像をリアルタイムに扱うことが,今後,課題になってくると思われる。現在,kV exposure40ms,その後約400ms(0.4s)で出力可能なため,もう少し装置をブラッシュアップすれば出力が速くなる可能性がある。400msというのは,かなりリアルタイムに近いが,若干の予測が必要になるかもしれない。
現時刻と直前の時刻の投影画像を用いて,患者の息止めが保たれているかどうかを確認する方法を検討している。
図10は,実際の症例の投影画像を約0.2°ずつ回転させて並べたものであるが,腫瘍の位置は実はそれほど変わっていない。相関関係をとってみると,画面全体で相互相関係数が0.99をはるかに上回っており,かなり一致している。つまり,この相関値が下がった場合,患者が動いているということになる。したがって,この投影画像をリアルタイムに出力して直前の投影画像と比較することで,体動の有無や息止めが保たれているかどうかを確認することができる。
また,別の考え方として,図11は別の症例におけるガントリ角73°での投影画像である。レジストレーション時の4D-CBCTデータから投影画像を再構成して10位相の三次元CBCT画像を作成し,これをテンプレートとして用意する。その上で,リアルタイムに出力された投影画像がこの10位相のうちのどれに相当するかということを相互相関係数をとって確認すれば,治療中に何もデバイスを使用せずに画像から呼吸曲線を描くこともできる。このテンプレートマッチングにはCross Correlation Coefficient,Structure Similarity Index,Mutual Informationといった手法があるが,ガントリ角73°ではいずれの手法でも実際の呼吸位相と予測した位相の一致度は高く,100°では完全に一致しており,かなり有望な方法であると考えている。また,これにより,体動の有無や息止めが保たれているかどうかを確認することができる。そして,このような位相認識システムは今後,画像の確認から治療の制御へと技術開発の方向性が変化していくと考えられる(図12)。
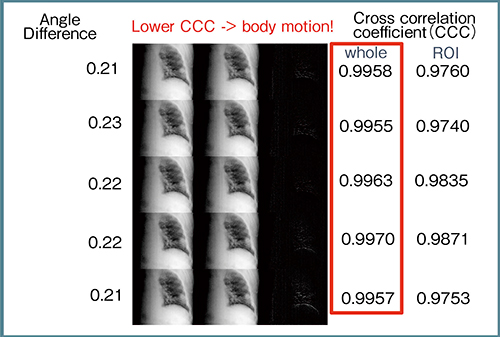
図10 投影画像の比較による体動および息止めの有無の確認
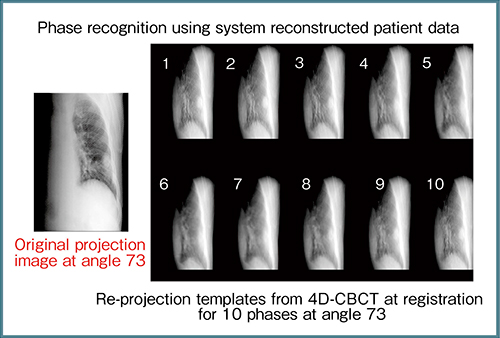
図11 ガントリ角73°での投影画像を活用した体動および息止めの有無の確認
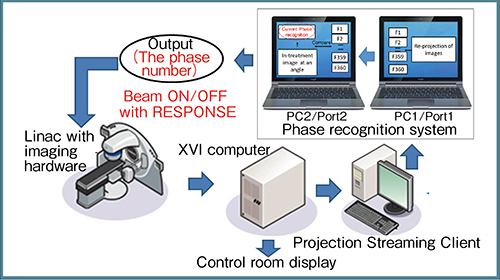
図12 VMAT-SRTの今後の展開
まとめ
VMAT-SRTを施行した肺がんの67症例について臨床成績をまとめた。患者の内訳はT1aが28症例,T1bが14症例,T2が6症例,metaが16症例であり,mean lung dose(MLD)は6.87Gyと低く,その結果,放射線肺臓炎はG2が6症例(9%),G3は0であった。また,2年局所制御率は,原発性腫瘍については92%,全生存期間も76%という良好な成績が得られた4)。
IGRTは,さまざまな歴史的変遷を経て現在,FFF VMAT-SRT+4D-CBCTが可能となっている。さらに,今後は4D-CBCTやリアルタイムの投影画像を活用し,治療時の照射制御へと技術開発の方向性が向かっていくものと思われる。
また,FFF VMAT-SRT+4D-CBCTはほとんどの肺がん症例に適用可能であるが,なかでも動きの大きい患者に対する息止め照射に有用であり,その場合も治療中の画像によるモニターが必須であると考える。
●参考文献
1)Takahashi, W., et al. : Verification of planning target volume settings in volumetric modulated arc therapy for stereotactic body radiation therapy by using in-treatment 4-dimensional cone beam computed tomography. Int. J. Radiat. Oncol. Biol. Phys., 86・3,426〜431,2013.
2)高橋 渉・他 : VMAT肺SBRT照射中に撮像した4次元CBCTによる腫瘍局在の確認. 日本放射線腫瘍学会第27回学術大会, 2014.
3)Nakagawa, K., et al. : Impact of flattening-filter-free techniques on delivery time for lung stereotactic volumetric modulated arc therapy and image quality of concurrent kilovoltage cone-beam computed tomography ; A spreliminary phantom study. J. Radiat. Res., 55・1, 200〜202, 2014.
4)Yamashita, H., et al. : Volumetric modulated arc therapy for lung stereotactic radiation therapy can achieve high local control rates. Radiat. Oncol., 9, 243, 2014.
東京大学医学部医学科卒業後,1985年東京大学医学部放射線医学教室入局。社会保険中央総合病院放射線科,東京大学医学部放射線医学教室助手,専任講師を経て,現在,東京大学医学部放射線医学教室准教授。2003年より東京大学医学部附属病院緩和ケア診療部長(兼任)。この間スイス Paul Sherrer Institute へ客員研究員として留学。
- 【関連コンテンツ】
