次世代の画像解析ソフトウェア(AZE)
2017年8月号
No.184 フュージョンと金属アーチファクト低減技術を併用した頭部CTA血管描出向上の取り組み
藤本 勤(医療法人社団 函館脳神経外科 函館脳神経外科病院放射線科)
はじめに
近年,脳動脈瘤クリッピング術に使用されるクリップにはチタンやコバルトクロム合金製の非磁性体が用いられ,MRI・CT共に金属アーチファクトが少ない画像が得られる。しかし,2000年頃まで使用されていたステンレス製などの強磁性体クリップは,頭部CTAにおいてかなり強い金属アーチファクトが発生し画像作成・診断に苦慮する。金属アーチファクトを低減する解決方法として,撮影体位の工夫やデュアルエナジー,各社CT装置に搭載されている金属アーチファクト低減技術によって金属アーチファクトが改善できているとの報告がある。
当院でのワークステーションと金属アーチファクト技術の活用
当院に2013年1月より導入したフィリップス社製CT装置「Ingenuity Core」には,整形外科用インプラント金属アーチファクト低減技術(Metal Artifact Reduction for Orthopedic Implants:O-MAR)が搭載されている。O-MARは本来,整形外科領域での大きな金属デバイスをターゲットとしているため,頭部領域での使用は推奨されていない。
当院は開院から30年経過しており,開院当初施行された未破裂あるいは破裂脳動脈瘤クリッピング術では強磁性体のクリップが多く使用されている。
フォローアップ検査は,MRI禁忌のため頭部CTAが施行されることが多い。O-MARを頭部領域に応用することによりクリップから発生する金属アーチファクトを低減することができ,血管描出が向上する症例を経験している。しかし,本来頭部領域での使用が推奨されていないため,O-MARの影響で新たなアーチファクトが発生し血管描出が低下するといったデメリットも生じる。
今回,このデメリットを解消するため,「AZE VirtualPlace雷神(以下,VirtualPlace)」(AZE社製)の標準機能であるフュージョンとO-MARを併用し,頭部CTAの血管描出向上を試みたので紹介する。
フュージョンとO-MARを併用した画像作成方法
O-MARを使用していない画像(以下,FBP),O-MARを使用した画像(以下,O-MAR)は,同じ生データから作成されているので位置情報はまったく同じである。2つの画像をフュージョンする目的は,「最大値で再構成」することである。フュージョン「最大値で再構成」を行うと,FBPとO-MARそれぞれの画像の血管最大CT値が再構成され,2つの画像をそれぞれ補った画像(以下,fusion)が得られる。
頭部CTAサブトラクションのfusion画像作成方法は2通りある。
(1) FBP造影画像からFBP非造影画像をサブトラクションする。O-MAR造影画像からO-MAR非造影画像をサブトラクションする。作成した2つのサブトラクション画像をフュージョン「最大値で再構成」する。
(2) FBP造影画像とO-MAR造影画像をフュージョン「最大値で再構成」する。次にFBP非造影画像とO-MAR非造影画像をフュージョン「最大値で再構成」する。それぞれ作成したフュージョン造影画像から非造影画像をサブトラクションする。
本稿では(1)の方法について紹介する。
FBP・O-MAR・fusion画像
FBP・O-MAR・fusion画像を紹介する。頭部3D-CTAのFBP元画像は,金属アーチファクトのため前大脳動脈の描出が不良である(図1 a)。O-MAR元画像では金属アーチファクトは低減され,前大脳動脈の描出は良好であるが,新たに発生したアーチファクトにより右中大脳動脈と右上小脳動脈が描出不良となっている(図1 b)。fusion元画像は,金属アーチファクトも低減しており,FBP・O-MAR両画像の血管最大CT値で再構成されるため血管描出が良好である(図1 c)。
MIP画像のFBPでは前大脳動脈が描出不良である(図2 a)。O-MARでは右中大脳動脈・右前大脳動脈・左後大脳動脈・両側上小脳動脈が描出不良である(図2 b)。fusionではFBPとO-MARで描出不良な血管がすべて良好に描出されている(図2 c)。
fusionのイメージ図を示す(図3)。fusionではFBP・O-MARが重なってピンク色の血管として表示されている。白く見える血管がFBP,赤く見える血管がO-MARのデータであり,お互いに画像を補っていることがわかる。

図1 頭部3D-CTA元画像(→:描出良好,→:描出不良)
a:FBP。金属アーチファクトにより前大脳動脈の描出不良である(←)。
b:O-MAR。金属アーチファクトは低減され前大脳動脈の描出良好である(←)。しかし,新たなアーチファクトが発生し右中大脳動脈・右上小脳動脈が描出不良である(↑)。
c:fusion。金属アーチファクトも低減され,すべての血管が描出良好である(←)。
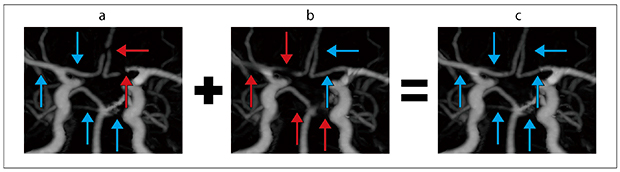
図2 頭部3D-CTA MIP画像(→:描出良好,→:描出不良)
a:FBP。前大脳動脈に描出不良箇所を認める(←)。
b:O-MAR。右中大脳動脈・右前大脳動脈・左後大脳動脈・両側上小脳動脈に描出不良箇所を認める(↑)。
c:fusion。すべての血管描出が良好である(↑)。
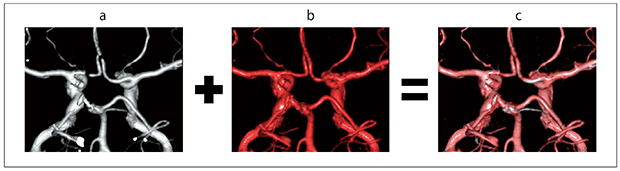
図3 頭部3D-CTA fusionイメージ図
a:FBP(白)
b:O-MAR(赤)
c:fusion。fusion画像では「最大値で再構成」しているため,FBP・O-MAR画像が重なって表示され,お互いの画像を補うように再構成される。
症例提示
●未破裂前交通動脈瘤(70歳,女性)
他院にてC型肝炎に対するインターフェロン療法のスクリーニング目的頭部3D-CTAで偶発的に前交通動脈瘤が発見され,手術目的で当院に来院した。
手術前の血管造影(右内頸動脈撮影)にて最大径10.7mm・ネック5.53mmの未破裂前交通動脈瘤を認めた(図4 a)。右前頭側頭開頭にて開頭クリッピング術を施行した。
手術ではチタン製クリップを4つ使用したため,手術後の頭部CTにて強い金属アーチファクトを認めた。頭部3D-CTAは金属アーチファクトが強く発生すると予測し,fusionとO-MARを併用した。頭部3D-CTAのFBP VR画像は右内頸動脈の描出は良好であるが,右中大脳動脈が一部欠損している(図5 a)。O-MAR VR画像は,右中大脳動脈の描出は良好であるが,右内頸動脈が描出不良である(図5 b)。fusion VR画像(図5 c)は右中大脳動脈・右内頸動脈とも描出良好であり,手術前の3D-DSA(図4 a)とほぼ同じ血管描出となっているのが確認できる。
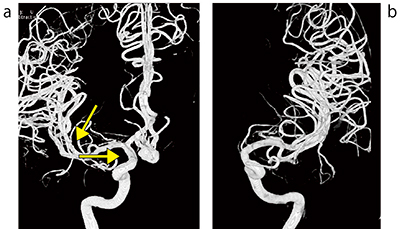
図4 症例:未破裂前交通動脈瘤
a:手術前3D-DSA 右内頸動脈撮影
b:手術前3D-DSA 左内頸動脈撮影
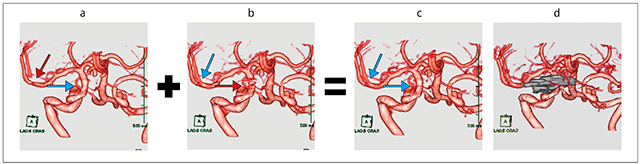
図5 症例:未破裂前交通動脈瘤手術後 頭部 3D-CTA(→:描出良好,→:描出不良)
a:FBP VR画像。右中大脳動脈が一部欠損している(↓)。
b:O-MAR VR画像。右内頸動脈が描出不良である(→)。
c:fusion VR画像 クリップなし。右中大脳動脈・右内頸動脈とも手術前の3D-DSAと同様に 描出良好である(→)。
d:fusion VR画像 クリップあり
まとめ
VirtualPlaceのフュージョン機能と金属アーチファクト低減技術を併用した頭部CTA血管描出向上の取り組みを紹介した。CT装置アプリケーションに依存し汎用性はないかもしれないが,ワークステーションとCT装置に搭載されているアプリケーションを融合させ新しい臨床画像を提供できる可能性があることが示唆された。
ワークステーションメーカーと装置メーカーが協働し,新しい技術が開発される一助となれば幸いである。
【使用CT装置】
Ingenuity Core(フィリップス社製)
【使用DSA装置】
AlluraClarity FD20/20(フィリップス社製)
【使用ワークステーション】
AZE VirtualPlace 雷神(AZE社製)
