セミナーレポート(キヤノンメディカルシステムズ)
2016年4月21日(木)~23日(土)の3日間,第102回日本消化器病学会総会が京王プラザホテル(東京都新宿区)を会場に開催された。22日(金)には,東芝メディカルシステムズ株式会社共催のランチョンセミナー21が行われた。今井康晴氏(東京医科大学八王子医療センター消化器内科教授)が座長を務め,「Aplioによる肝臓腫瘍診断の最前線」をテーマに,杉本勝俊氏(東京医科大学消化器内科講師)と麻生和信氏(旭川医科大学内科学講座病態代謝内科学分野講師)が講演した。
2016年7月号
第102回日本消化器病学会総会ランチョンセミナー21 Aplioによる肝臓腫瘍診断の最前線
肝腫瘍診断におけるSMIとSWE ─使いこなしていますか?─
杉本 勝俊(東京医科大学消化器内科)
東芝メディカルシステムズ社が開発した“Superb Micro-vascular Imaging(SMI)”と“Shear Wave Elastography (SWE)”の2つの新しい技術をどのように肝腫瘍診断に生かすか,われわれの施設での経験も踏まえ,その活用法を紹介する。
肝腫瘍診断におけるSMIと造影SMI
非造影による新しい血流表示法であるSMIは,従来のドプラ技術“Advanced Dynamic Flow(ADF)”に比べてフレームレートが向上し,モーションアーチファクトを抑制する技術である。SMIには,Bモードに血流を重ねて表示する“color-coded SMI(cSMI)”と,血流信号のみを白黒表示する“monochrome SMI(mSMI)”の2つの表示法がある。
われわれは,SMIの血流表示について,従来法であるカラードプラ,パワードプラ,ADFとの比較を行った。図1は,門脈血栓症の症例であるが,カラードプラ(図1 a)では門脈に淡い高エコーの血栓が認められ,肝動脈の血流を描出できているものの,門脈の血流を評価できない。パワードプラ(図1 b),ADF(図1 c)も同様である。しかし,cSMI(図1 d)では,非常に低速な門脈血流が存在することが示唆された。このようにSMIは,非常に遅い血流でも感度良く描出できることが特長である。
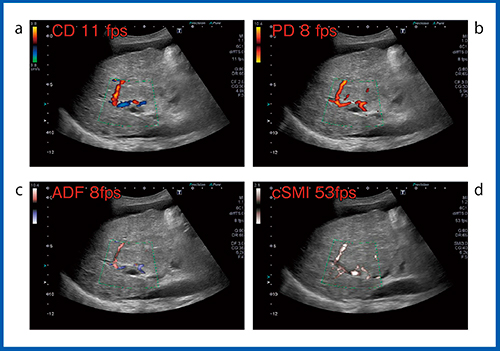
図1 SMI(d)とカラードプラ(a),パワードプラ(b),ADF(c)
との比較(門脈血栓症)
また,図2の膵神経内分泌腫瘍(膵NET)の肝転移症例では,ADF(図2 a)において腫瘍血管の同定が困難であったが,mSMI(図2 c)は腫瘍内に流入する血管の構築が描出できており,多血性腫瘍であることがわかる。ただし,心拍動によるモーションアーチファクトが出ているため造影SMI(図2 d)を行ったところ,非常に鮮明な腫瘍血管像を得ることができた。
この経験を踏まえ,肝腫瘍における造影SMIの有用性について,観察者実験による評価を行った。対象は,2015年6~10月の4か月間に,肝腫瘤性病変の鑑別診断目的でソナゾイド造影超音波検査を行った連続37症例37結節で,平均腫瘍径は26mmである。使用装置は「Aplio 500」で,検査プロトコールはソナゾイド0.5mL/bodyを肘正中静脈から静注し生食10mLを1mL/sの速度で後押しして,通常の造影モード(PS-Low)で静注開始から1分間血管相,その後Low MI SMIで主に門脈相,10分後にPS-LowモードでKupffer相を撮像した。さらに,セットA(造影超音波の血管相,Kupffer相)と,造影SMIを加えたセットBの2つの画像セットを用意し,3名の肝臓内科医が読影した。
その結果,肝細胞がん(HCC)と限局性結節性過形成(FNH)では,2名の観察者において,造影SMIのあるセットBの方が統計学的に有意に確信度が上昇した。ただし,セットAとセットBの診断結果は同じであったので,造影SMIだけでは診断結果を変えるほどのインパクトはないと考える。
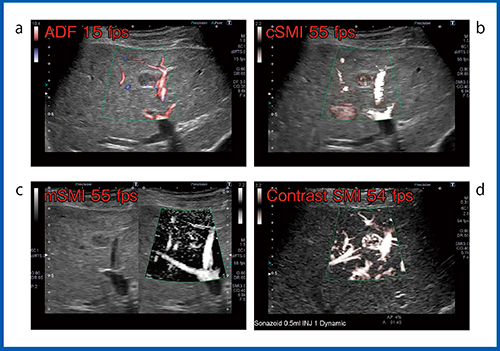
図2 造影SMI(d)とADF(a),SMI(b,c)との比較(膵NETの肝転移)
造影SMIが有用であったFNHの症例を示す(図3)。血管相(図3 a)において多血性の腫瘤が認められ,経験豊富な医師は血流が中心から周囲に向かって流れていることを理解できるが,経験の浅い医師には多血性腫瘍と見誤り,FNHと診断することが困難と考えられる。そこで,造影SMI(図3 b)を行うことにより,中心から放射状に広がる血管構築が明瞭に描出され持続的に観察でき,FNHと診断できる。FNHのように多血性で血管構築が明瞭な症例や,HCCにおけるバスケットパターンなどに造影SMIは有用である。
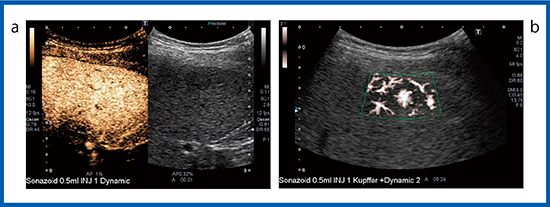
図3 FNHの造影SMI
a:造影超音波 b:造影SMI
図4は脂肪肝で,Bモード画像(図4 a)においてS4背側に2cm台の低エコーの結節があった。通常の造影超音波検査では描出されず,高音圧の造影SMI(図4 b)を施行すると,低エコー結節の中の血管構築が描出された。このことから腫瘤性病変ではなく右胃静脈の還流異常によるfocal spared areaであると確定診断できた。
このように,SMIは非造影下でも有用であるが,造影下で使用することで, さらに有用性が高まる。また,造影SMIは通常の造影検査の合間に施行できることも利点である。
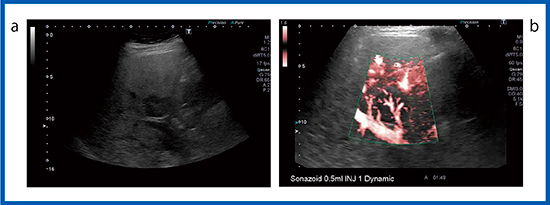
図4 脂肪肝の造影SMI
a:Bモード b:造影SMI
SWEによる肝腫瘍診断の有用性
エラストグラフィは,strain imagingとshear wave imagingの2つに大別される。励起法としては,用手的加圧を行うmanual compression,音響放射圧を用いるacoustic radiation force impulse,機械的に振動を与えるmechanical vibration and impulseがあり,東芝メディカルシステムズ社のSWEはacoustic radiation force impulseを用いている。SWEの原理は,プッシュパルスで組織内部に剪断波を発生させて,剪断波が伝播していく速度をドプラパルスで計測し,弾性率を算出する。さらに,特長としては,剪断波の発生から伝播していく経過を1枚の静止画で信頼性高く観察できる“到達時間等高線表示”ができることが挙げられる。SWEは,正常肝の場合,剪断波が均一に伝播していくが,肝硬変など組織の硬い部分は伝播が速くなり,赤色で表示される。このことからSWEは,びまん性肝疾患,特に肝線維化診断において有用である。
しかし,肝腫瘍のSWEは,まだ診断法として確立しているとは言えないため,われわれはその有用性について検討を行った。対象は,2015年6~10月の4か月間にSWEを行った腫瘤性病変の連続106症例106結節で,平均腫瘍径は29.8mmであった。
症例ごとに弾性率を比較すると,最も組織が硬かったのが胆管細胞がん(CCC,中央値=77.8kPa),2番目は転移性肝がん(Meta,中央値50.2kPa)で,次いでHCC(中央値=40.6kPa)となった。以降,良性の結節が続き,肝血管腫(Hema,中央値=28.0kPa),FNH(中央値=24.4kPa),肝細胞腺腫(HCA,中央値=11.6kPa)となった。また,良・悪性疾患における弾性率を比較すると,良性結節の場合は中央値が26.9kPa,悪性結節の場合は中央値が46.1kPaとなり,統計学的有意差をもって悪性結節の方が弾性率が高いという結果になった。ただし,ROC解析を行うとAUC値=0.689となり,最適なカットオフ値を40.5kPaとすると,感度が58.6%,特異度が39.1%となった。このことから,SWEで良・悪性の鑑別を厳密に行うことは難しいと考える。
図5はHCC症例であるが,病変が赤く表示され,組織が硬いことがわかる。弾性率は106.7kPaで,非常に硬い腫瘍であった。図6もHCC症例であるが,腫瘍中心部の弾性率は15.4kPaと低く,軟らかい組織である。ただし,背景肝の弾性率は126.6kPaと高く,これはアルコール性肝硬変であることを示している。
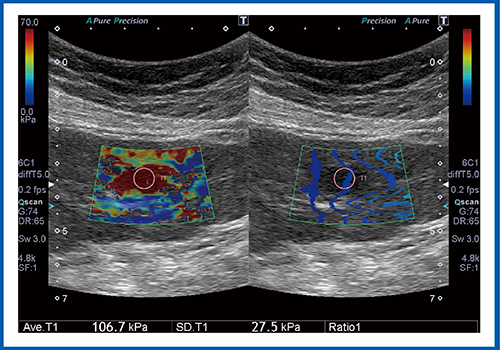
図5 HCCのSWE
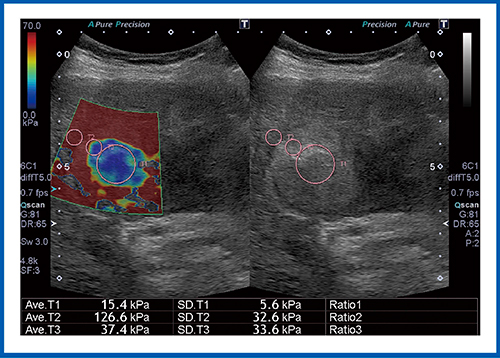
図6 HCC(アルコール肝硬変)のSWE
図7は,大腸がんの肝転移症例である。本症例は肝臓の大部分にわたる占居性病変(SOL)であり,弾性率は173.4kPaと,非常に硬い値を示した。
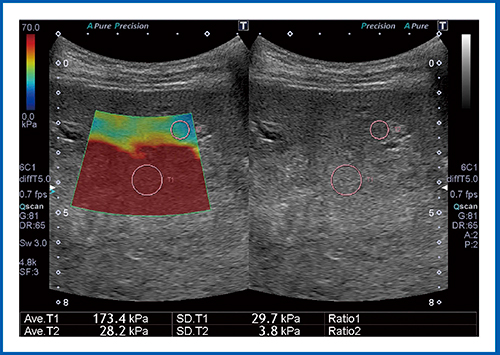
図7 大腸がんの肝転移のSWE
図8は,肝血管腫の症例である。赤く表示されている結節の弾性率は109.1kPaとなっており,値だけを見ると悪性腫瘍が疑われるが,ほかの画像も併せて読影することで,肝血管腫であると診断できた。
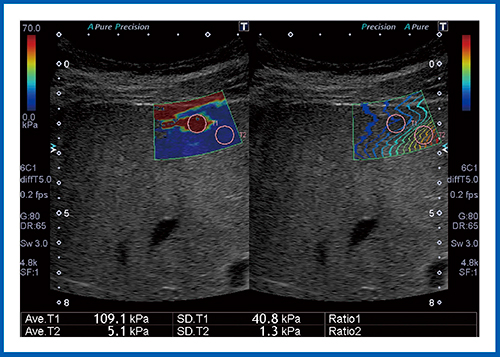
図8 肝血管腫のSWE
図9は,膵NETの肝転移症例である。造影SMI(図9 a)ではリング状の染まりがありその内部に血流が見られるが,SWEでは,カラーマップ表示されなかった(図9 b)。腫瘍の部分に剪断波が生じていないことから,肝転移のような硬い組織の場合,プッシュパルスでは剪断波が発生しない可能性が示唆された。また,浅部側は多重反射などのアーチファクトがあるほか,深部側や横隔膜近傍のS8はカラーマップ表示が難しい場合がある。
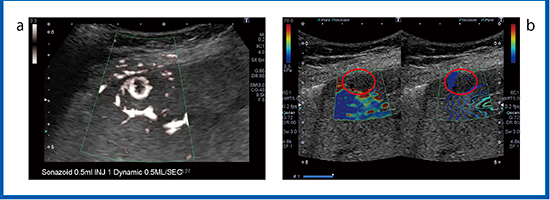
図9 膵NETの肝転移のSWE
a:造影SMI b:SWE
以上のことから,われわれの検討では,弾性率の測定値が腫瘤性病変の性質をよく反映しているという結果になった。ただし,測定値だけでは良・悪性の鑑別は不十分であり,また,非常に硬い組織や深部側の腫瘍など計測できない症例があることも明らかになった。
当院におけるSMIとSWEを取り入れた検査プロトコール
当院で施行している肝腫瘍診断を目的とした超音波検査のプロトコールを図10に示す。まずBモードで形態診断を行い,その後非造影でADF,cSMI,mSMI,SWEを施行する。われわれの検討では,造影後にSWEを行うと測定値にバラツキが見られたため,造影前に行うことにしている。非造影の検査後にソナゾイド造影超音波を施行し,造影後60秒までの血管相を観察後,造影SMIを行って血管構築を中心に評価する。それからスキャンをいったん停止して,10分後にKupffer相を観察する。
現時点では,SMIとSWEをどのように肝腫瘍診断に用いるのか明確な基準はないが,当院ではこのようなプロトコールで総合的な診断を行っている。
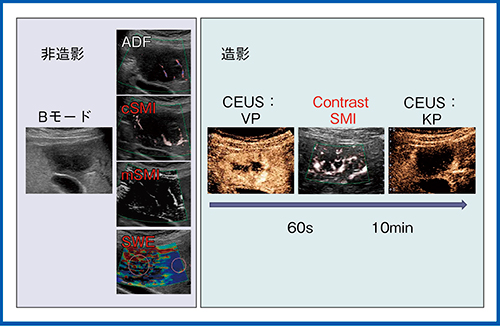
図10 当院におけるSMIとSWEを取り入れた検査プロトコール
◎
従来の超音波検査にSMIとSWEを加えることは,肝腫瘍の鑑別診断に有用であると考える。特に造影SMIは,腫瘍の血管構築を観察する上で,きわめて有用なブレークスルー技術であり,日常の造影超音波検査において,広く一般的に行われるべき検査法と考える。

杉本 勝俊(Sugimoto Katsutoshi)
2000年 東京医科大学卒業。2006年 同大学消化器内科助教。2008〜2009年 シカゴ大学放射線科に留学。2015年~東京医科大学消化器内科講師。
- 【関連コンテンツ】
