セミナーレポート(キヤノンメディカルシステムズ)
第62回日本核医学会学術総会が2022年9月9日(金)〜11日(日)に国立京都国際会館(京都府京都市),10月3日(月)〜11月30日(水)にWebでハイブリッド開催された。9月10日(土)に行われたキヤノンメディカルシステムズ株式会社共催のランチョンセミナー15では,ハイメディッククリニックWEST脳卒中内科の橋川一雄氏が司会を務め,大阪公立大学医学部附属病院中央放射線部の山永隆史氏と日本赤十字社旭川赤十字病院医療技術部放射線科核医学技術課の岡林篤弘氏が,「GCA-9300R:New CBF Quantification Method without Blood Sampling(GCA-9300R 新たな非採血脳血流定量法)」をテーマに講演した。
2022年12月号
第62回日本核医学会学術総会ランチョンセミナー15 GCA-9300R:New CBF Quantification Method without Blood Sampling(GCA-9300R 新たな非採血脳血流定量法)
99mTc製剤用非採血脳血流定量法の検討(IBUR法)
山永 隆史(大阪公立大学医学部附属病院中央放射線部)
大阪公立大学医学部附属病院では現在,キヤノンメディカルシステムズ社製の3検出器型SPECT「GCA-9300R」をはじめとする3台のSPECTおよびSPECT-CTのほか,2台のPET-CTが稼働している。当院では,1993年から26年間にわたり,3検出器型SPECT「GCA-9300A」を使用しており,優れた空間分解能を有する3検出器型装置を高く評価していた。そこで,装置の更新に当たってGCA-9300Rが選定され,2019年4月に導入された。
本講演では,GCA-9300Rを用いた99mTc製剤用非採血脳血流定量法の検討について報告する。
3検出器型と2検出器型の比較
図1は,3D脳ファントムを3検出器型(FANSHRコリメータ)と2検出器型(LEHRコリメータ)で30分撮像し,FBP法で再構成した画像である。2検出器型では,信号の統計量が少なく強めのフィルタをかける必要があるため,若干ボケた印象になる。一方,3検出器型では線条体などの構造物の分離がある程度は可能である。また,コリメータ開口補正が組み込まれた3D-OSEM法では,2検出器型でも構造体が明瞭に描出されるが,3検出器型ではさらに明瞭な画像が得られる(図2)。
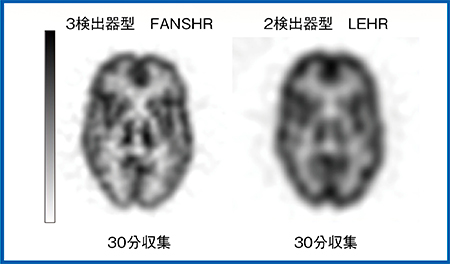
図1 3検出器型と2検出器型の比較(FBP再構成)
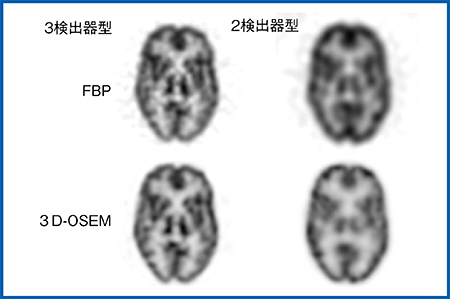
図2 3D-OSEM法(コリメータ開口補正)
IBUR法とPatlakPlot法
脳血流シンチグラフィの利点は,Lassen補正などの定量法により,定性画像から局所脳血流画像を作成し,定量化できることである(図3)。脳血流定量法には,動脈採血法のほか,非採血での非侵襲的な方法がある。非採血脳血流定量法のうち,以下では,99mTc-ECDを用いたimproved brain uptake ratio(IBUR)法について紹介する。
PatlakPlot法は,大動脈弓部と大脳半球を撮像範囲に収め,大動脈弓部と大脳半球に関心領域(ROI)を設定し,時間放射能曲線(time activity curve:TAC)を作成する。さらに,133Xe-SPECTを用いた回帰式により,brain perfusion index(BPI)値を平均脳血流量値(mCBF値)に変換する。
一方,IBUR法は,大動脈弓部をガンマカメラに収めてダイナミック収集を2分間行い,上行大動脈に自動でROIが設定され,TACを作成する。さらに,SPECTのROI内カウント,area under the curve(AUC),cross calibration factor(CCF)からbrain uptake ratio(BUR)値を算出し,15O水PETを用いた回帰式〔局所脳血流量値(rCBF値)=3.23×(IBUR)+4.66〕によりmCBF値に変換する(図4)。なお,BUR値は,brain SPECTの基底核スライスROI内の平均カウントとCCFを掛けてAUCで除した値である。このAUCは,二峰性の2番目のピークをガンマフィッティングした時のカウントの積分値であり,CCFは平面と断面を変換する係数である。
当院では,CCFは6分/1回転×6回転(36分)を最大値に設定している。統計ノイズを一定にするため,total count 3500kcountsを目標とし,3500kcountsを超えた回転数で収集を終了するという方法を採用している。そのため,午前中は放射能(アクティビティ)が多く検査は約3回転(18分)ですむが,午後は約5回転(30分)となる。また,患者の容体により検査を中断するケースもあり,回転数に応じたCCFが必要となる。実際のIBUR法の結果を図5に示す。
three-dimensional stereotaxic ROI template(3DSRT)にて局所脳血流を算出し,PatlakPlot法とIBUR法の比較を行った報告では,IBUR法で得られたmCBF値とrCBF値の範囲はPatlakPlot法で得られた範囲より約60%広く,IBUR法はより低血流領域の診断に役立つと結論づけられている1)。当院でも計100症例を対象に両手法を用いてmCBFの群間比較を行ったところ,mCBF値の最大値に大きな差はないものの,IBUR法では最小値が低く,低血流を反映した値になったと考えられた(図6)。
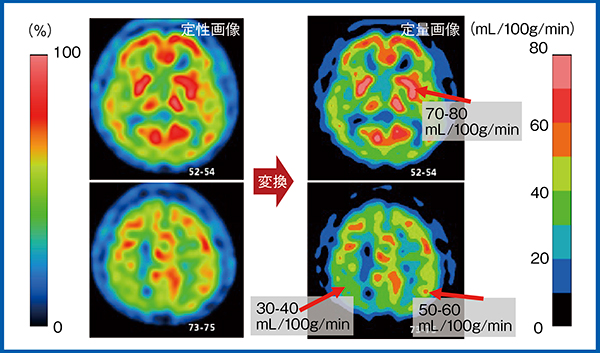
図3 定性画像から局所脳血流画像を作成し定量化
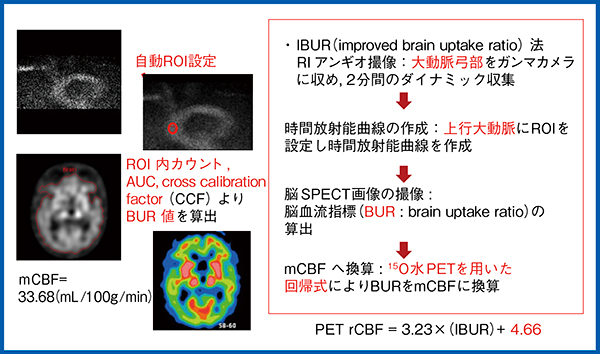
図4 IBUR法の概要
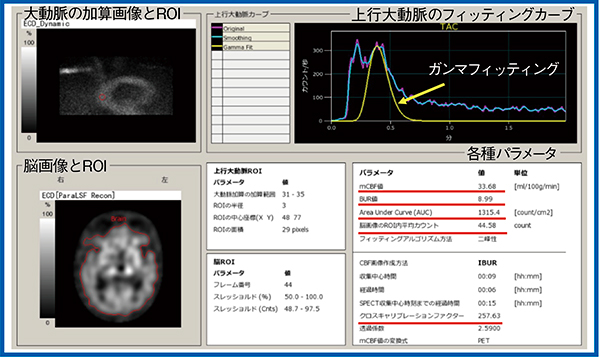
図5 IBUR法の結果
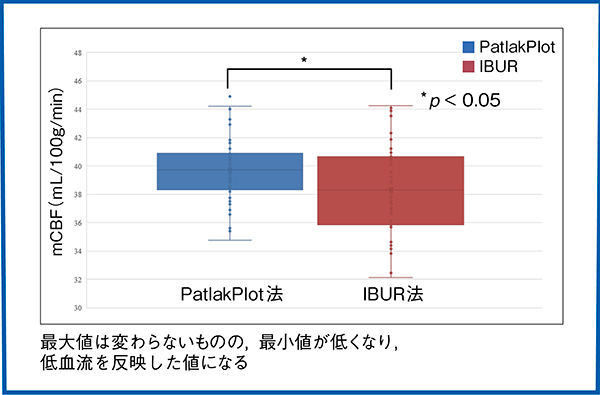
図6 PatlakPlot法とIBUR法のmCBF値の比較
IBUR法の利点
IBUR法の利点として,以下の4点が挙げられる。
1)3検出器型SPECT1台で脳血流シンチグラフィを完結可能
通常の汎用型2検出器型SPECTは,3インチの光電子増倍管(PMT)53本と2インチPMT6本で構成されているのに対し,3検出器型SPECTであるGCA-9300Rはすべて2インチPMTで構成されている(図7)。GCA-9300Rでは,有効視野の面積あたり2倍以上の密度でPMTが配置されているため,精密な位置の演算が可能となり,空間分解能を重視した設計となっている。ただし,有効視野が狭いことは課題である。PatlakPlot法では,まず大視野ガンマカメラ(2検出器型SPECT)で大動脈弓と大脳半球のダイナミック撮像を行った後,検査室を移動してGCA-9300RでSPECT撮像を行う必要がある。一方,IBUR法では検査室を移動することなく検査を完結できるため,移動に伴う患者の転倒リスクを回避することができる。さらに,1台の装置で検査が行えるため,もう1台の装置で同一時間枠に別の検査を施行できる点も有用である。
また,視野が狭い検出器で大動脈弓部から上行大動脈の範囲をダイナミック撮像するには,位置合わせのために一定の基準を作成する必要があった。そこで,GCA-9300Rのレーザーポインタから410mm離れた場所に検出器の上縁が位置することを利用し,咽頭隆起をレーザーに合わせ,410mm奥に移動することで大動脈弓から上行大動脈までを撮像範囲に収めるという手法を考案した(図8)。これにより,3検出器型SPECT1台で脳血流シンチグラフィを完結することが可能になった。
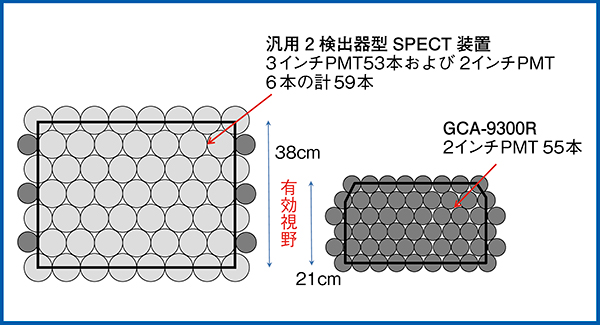
図7 2検出器型と3検出器型のPMT配置と有効視野の比較
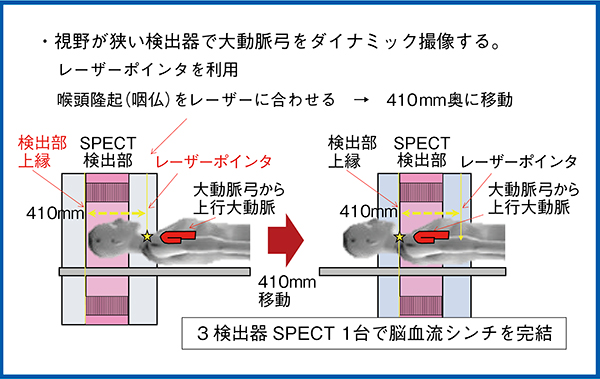
図8 GCA-9300Rでの大動脈弓部の位置合わせ
2)ダイナミック撮像からSPECT撮像までファンビームコリメータを使用
従来,原理的な実効感度の違いから,ダイナミック撮像は平行多孔型,SPECT撮像はファンビーム型のコリメータをそれぞれ使用していた。平行多孔型は,線源−コリメータ間距離に感度や画像サイズは依存しない。しかし,ファンビーム型はコリメータとファンビーム焦点の距離(f),コリメータと線源の距離(b)に対し,実効感度はf/(f−b),実効ピクセル長は(f−b)/fに比例する。そのため,ファンビーム型は線源−コリメータ間距離によって感度や画像サイズ,ピクセル長が変化し,入力関数の測定はできないとされてきた(図9)。
そこで,2018年に猿渡らが入力関数用のROIサイズを胸部大動脈より小さく変更して検討したところ,線源−コリメータ間距離を短くすることでカウント変化が縮小するため,ファンビーム型コリメータによる入力関数の測定は実用可能であり,検査中のコリメータ交換は不要であると結論づけられた2)。
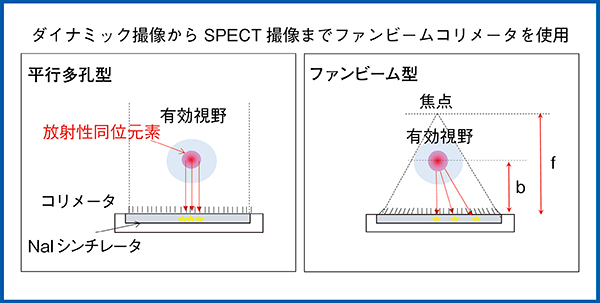
図9 平行多孔型とファンビーム型の違い
3)上行大動脈から入力関数を推定
上行大動脈は大動脈弓に比べ,血流動態の誤差が少ないとされている。小山内らが行った体外循環時の大動脈弓部の血行動態の数値シミュレーションでは,大動脈弓部で上行大動脈の渦が弓部血管壁への衝突によって向きが変わり,速度も低下した。すなわち,大動脈弓部にROIを設定して入力関数を得ようとすれば,分岐による血流欠損や渦の衝突による血流速度低下が生じるため,正確かつ安定した入力関数が得られず,BUR法によって得られた脳血流の値にも誤差が生じると考察されている3)。
そこで井上らは,同一患者の上行大動脈,大動脈弓部,下行大動脈の3か所にBUR法でROIを設定して得られたrCBF値と,123I-IMPを用いた持続動脈採血法(microsphere:MS法)で得られたrCBF値を比較した。その結果,上行大動脈にROIを設定したケースが最も相関性が高く,BUR法による入力関数決定のための最適ROIは,血行動態の誤差が少ない上行大動脈部が理論的かつ実験的に最適であると報告されている4)。
4)自動ROI解析
自動ROI解析のフローは以下のとおりである。まず胸部RIアンギオグラフィ画像を撮像し,ピクセルサイズをそろえる。続いて,静脈peak frameおよび動静脈相領域を決定して静脈相画像と動脈相画像,大動脈弓相画像を作成し,上行大動脈候補領域画像を作成して,上行大動脈部ROIを決定する5)。
静脈peak frameおよび動静脈相領域の決定に当たっては,得られたダイナミック画像の全視野にROIを設定し,TACカーブを作成する。最も高いカウント値を静脈peak frame(a),微分曲線の最も低い箇所を境界領域(d)とし,aとdの間を動静脈相領域(b),d以降を体循環領域(c)とする。
次に,動静脈相領域(b)を動脈相領域と静脈相領域に分離するため,静脈相領域では鎖骨下静脈から大動脈弓までの通過時間を4パターンに分けてフレーム加算を行い,静脈相以降,境界領域までを加算したものを動脈相領域とする。さらに,動脈相画像に対して二値化処理(Pタイル法)を行い,画像の最大領域を検索して大動脈弓の候補画像を決定する。二値化した動脈相画像と静脈相画像を掛け合わせ,上行大動脈候補画像を作成した後,半径4ピクセル(8.76mm)のROIを設定し,最大ピクセル値を検索する。
ROIの最大ピクセル値を検索するアルゴリズムでは,上行大動脈候補画像と胸骨の重なりが問題となるが,LAO25°では胸骨部と上行大動脈部が分離されることから,LAO20°~30°に傾けるのが理想である。熊本大学の伊藤らの検討でも,正面などと比較して,LAOが一致率が高いとされている。
当院にて,2020年10月から連続100症例の上行大動脈候補領域の一致率を検討した結果,LAO25°では一致率98%(98/100例)であった(図10)。なお,残りの2症例は,上行大動脈が不明瞭なため下行大動脈にROIを設定した(図10 b)ほか,鎖骨下静脈のうっ帯により鎖骨下静脈にROIを設定した(図10 c)。このように,ROIの自動設定が適切でない場合でも,手動で設定し直すことで解析は可能である。
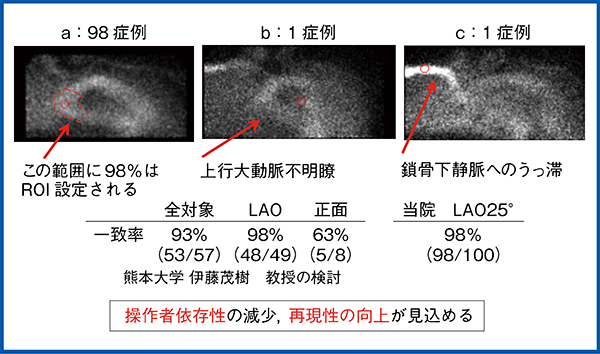
図10 当院の連続100症例における上行大動脈候補領域の一致率
まとめ
非採血脳血流定量法であるIBUR法の利点を4点紹介した。これらの特長から,IBUR法は有用であると考えられる。
* 記事内容はご経験や知見による,ご本人のご意見や感想が含まれる場合があります。
●参考文献
1)Nagaoka, R., et al.: Asia Ocean J. Nucl. Med. Biol., 3(2): 77-82, 2015.
2)猿渡一徳,他:ファンビームコリメータを用いた非採血脳血流定量法〔improved brain uptake ratio(IBUR)〕の基礎的検証. 日本放射線技術学会雑誌, 74(11): 1302-1312, 2018.
3)小山内聡史,他:体外循環時における大動脈弓内流れの数値シミュレーション. 脈管学, 48(3): 313-318, 2008.
4)井上信哉,他:99mTc-ECD非侵襲的脳血流定量法(Brain Uptake Ratio)における入力関数の最適ROI設定位置の決定. 日本放射線技術学会雑誌, 68(3): 269-276, 2012.
5)Masunaga, S., et al.: Phys. Med., 30(4): 513-520, 2014.
一般的名称:核医学診断用検出器回転型SPECT装置
販売名:デジタルガンマカメラ GCA-9300R
認証番号:225ADBZX00120000

山永 隆史(Yamanaga Takashi)
1999年 清恵会第二医療専門学校卒業。社会医療法人生長会ベルクリニックに入職。2000年 大阪市立大学医学部附属病院(現・大阪公立大学医学部附属病院)中央放射線部に入職。現在に至る。
- 【関連コンテンツ】
