New Horizon of 4D Imaging(ザイオソフト)
2017年1月号
Ziostation2に搭載した最新テクノロジー三次元医用画像認識技術“RealiZe”
安達雅昭(ザイオソフト株式会社 臨床応用開発グループ)
ポストプロセッシングにおける医用画像処理は、その当初から臓器の抽出や骨取り技術などの課題が存在した。さらにCT装置の多列化とともに冠動脈やアダムキュービッツ動脈などの微細な血管を抽出したいというニーズが生まれ、さまざまな自動処理機能が開発されてきた歴史がある。当社は、長きにわたり行われてきた手作業でのルーチン作業の効率化や受診者側のメリット向上も含めて、新しい自動処理や処理精度の向上を念頭に新技術の開発を続けている。Ziostation2の新バージョンより搭載された技術が、今回ご紹介する“RealiZe(Recognition of Exact Anatomical Landmark Information with Ziosoft Enhancement)”である。PhyZiodynamicsを発展させた三次元医用画像認識技術である“RealiZe”は、さらなる画像診断の支援に寄与するものである。
“RealiZe” とは
医用画像では、撮影条件や人体の年齢、性別、サイズなどにより、同じ器官でも形状や大きさ、位置などがそれぞれ異なる。さらに人によって、例えば血管であればその発達の仕方はさまざまで、走行や形状は皆、異なる。また、疾患を伴う場合は複雑なパターンも生じる。そこで、RealiZeは従来のアルゴリズムに加え、“解剖学的認識”と“血管連続性”に関する2つのアルゴリズムを加えることで、血管や臓器の認識精度を高め、血管の自動抽出など従来のCT値差を利用したセグメンテーションでは不可能な処理を可能にした。解剖学的認識アルゴリズムでは、さまざまなパターンに応じて血管走行や器官形状など解剖学的な認識を行い、分離すべき器官をより正確に判断する。血管連続性アルゴリズムでは、CT値に差がない血管が隣接あるいは並走していても、血管の起始部からの連続性や末梢血管の構造を判断し血流方向を推定することで、個々の血管の連続性を正確に追跡することができる。
本稿では、すべての部位の解析アルゴリズムについては紹介できないが、脳血管における動静脈分離のアルゴリズムについて解説を行う。脳血管の分離を行うに当たり、Ziostation2にすでに搭載されている肺動静脈自動分離アルゴリズムを脳に適用すれば可能なように感じられるが、そのような組み合わせでできるほど容易ではない。なぜなら、脳血管は人体の中で最も複雑で難しい部位であるがゆえに、血管走行の個人差も非常に大きいからである。図1は、脳動静脈分離を行っている際の解剖学的認識アルゴリズムを適用させているものであるが、中枢血管の解剖学的血管構造が個人によってまったく違うのが把握できる。この解剖学的認識は図2に示す通り、段階的に血管の解剖学的構造を認識させていき、中枢部の血管構造を動脈と静脈に分離していく。その後、血管連続性アルゴリズムを使用して、それぞれの動脈と静脈の連続血管を認識させ分離を行っている。
なぜ、このような方法が必要であるかと言うと、1相で撮影された脳血管動静脈の分離を行うにはCT値差を利用した分離が不可能なためであり、加えて脳血管の走行が複雑な解剖構造であること、また動脈血管と静脈血管が隣接、並走していることによる分離の難しさが挙げられる。
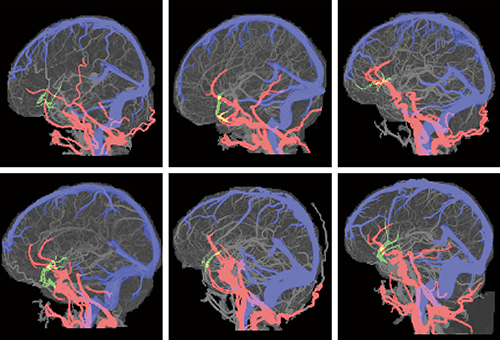
図1 患者間における中枢血管の走行の違い(解剖学的認識アルゴリズム適用)
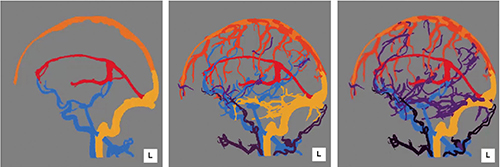
図2 解剖学的認識アルゴリズムの認識力
脳動静脈分離
図3は、実際の臨床画像を用いて動脈と静脈のシード抽出を行った画像である。その後、血管連続性アルゴリズムを用いて、動脈と静脈を自動で分離している。
前大脳動脈の交通後部は、前大脳動脈の末梢側で後方に向かって走行しており、下矢状静脈洞は大脳鎌の下縁に沿って走行し、個人差はあるものの、この両者がCT画像上で並走するケースは多い。分離後のVR画像(図4 a、b)では前大脳動脈と下矢状静脈洞が並走していること、さらに複数の位置で両者が接していることがよくわかる。一部拡大したものを図4 cに示す。アキシャル画像上に配置したプロファイルカーブ(図4 d)からもわかるように、右側の前大脳動脈と中心を走行している下矢状静脈洞のCT値は共に300HU弱で、この両者にはCT値差がなく動脈と静脈の境界も不明瞭である。同位置における前大脳動脈と下矢状静脈洞のマスク(図4 e、f)を確認すると、中心を走行する下矢状静脈洞は最も細い部分でわずか2ボクセルほどの領域であり、この並走した部分のセグメンテーションには解剖学的な認識技術と血管連続性の認識技術がなければ分離が難しい処理であることを確認できる。
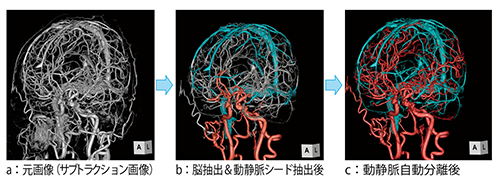
図3 解剖学的認識アルゴリズムを用いた動静脈のシード抽出と血管連続性アルゴリズムを用いた脳動静脈分離
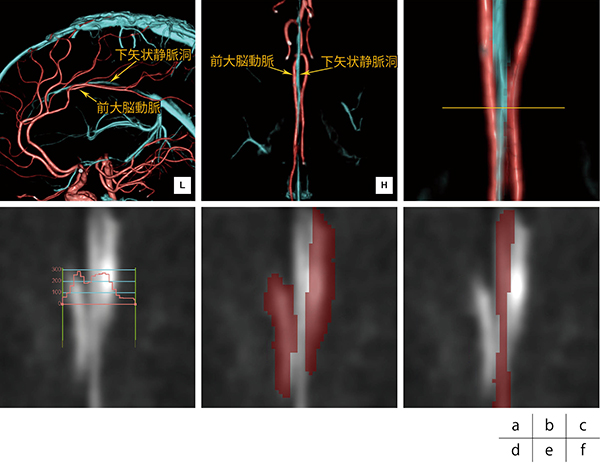
図4 前大脳動脈と下矢状静脈洞の位置関係と隣接部分のCT値とボクセルの関係
CT冠動脈解析2
従来のアルゴリズムではCT値の連続性を利用しているため、慢性完全閉塞症例などでは冠動脈の閉塞部分のCT値が低すぎて抽出することが困難であったが、RealiZeを搭載することで抽出を可能としている(図5)。
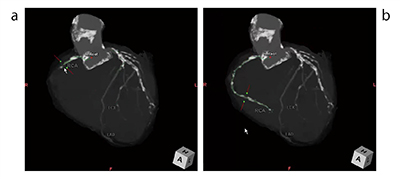
図5 RealiZeを搭載した新しいCT冠動脈解析2
a:従来処理 b:RealiZe
腎臓抽出
腎囊胞などで巨大化している腎臓のボリューム計測を行う施設が近年増えつつある。これはサムスカ錠(大塚製薬株式会社)などの薬剤の適応を決定するために需要がある。薬の添付文書には、
(1) 両側総腎容積が750mL以上であること
(2) 腎容積増大速度がおおむね5%/年以上であること
と記載されており、そのニーズに沿った形で、腎臓を選択的に抽出する機能を開発した(図6)。RealiZeを使用することで非造影の腎臓であっても解剖学的情報を認識しているため、ワンクリックで抽出することが可能である。
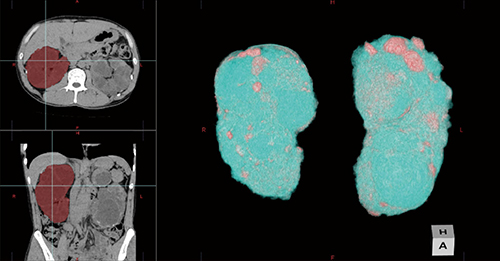
図6 腎臓抽出機能
頭部MRA解析
MRAが普及してから10年以上、手動にて画像作成を行っていた作業の新たなイノベーションとして、MRA自動抽出機能を搭載した「頭部MRA解析」を2015年リリースした。図7 aは従来アルゴリズムで作成した画像であるが、上矢状静脈が写り込んでいるため、MIPにも反映されているのがわかる。
図7 bはRealiZeによるものだが、解剖学認識アルゴリズムにより上矢状静脈が撮像されていても自動的に削除されるようになった。
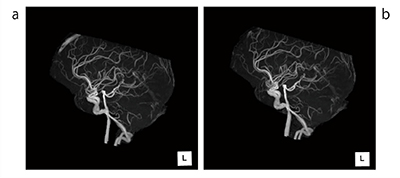
図7 RealiZeを搭載した頭部MRA解析
a:従来処理 b:RealiZe
肺五葉分割(W.I.P.)
肺の診断において、今まで気管支の抽出などは存在したが、五葉分割は長きにわたって手動で行われていたのが現状である。現在当社では、さらなる解析の効率化と時間の短縮、そして正確性を担保した、「肺五葉分割」機能を開発中である。図8は自動分割後のマスク表示の画像であるが、葉間裂をしっかりととらえて分割していることがわかる。時に葉間裂は薄く認識しにくいものも存在するが、RealiZeテクノロジーにより解剖学的情報を基に分離しているため、より正確な分類が可能である。
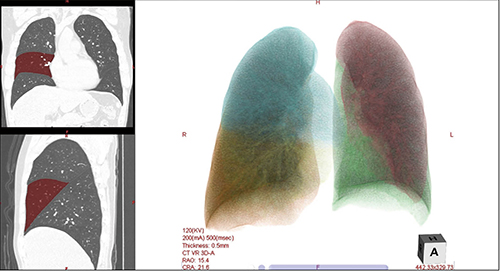
図8 RealiZeを使用した葉分割マスク
おわりに
RealiZeは、ポストプロセッシングにおける画像作成時間の短縮に寄与するだけではない。正確な画像診断に寄与することはもちろん、手術の精度や薬剤の適正な投与量の算出、人工器具のサイズ選択や設計、および再生医療のための算定条件の検討に役立てられる。さらに術者によるバラツキの低減や被ばく低減などのメリットが生まれることも期待している。当社は今後も新技術の開発を通じて医療に貢献していきたいと考えている。
