Varian社製RALSによる国内での臨床経験
Varian Oncology Summit 2022
2022-11-15
座長:戸板 孝文(沖縄県立中部病院放射線治療センター)
-
当院におけるBRAVOSの初期使用経験
中嶋 綾(京都大学医学部附属病院放射線治療科) -
組織内照射を利用する
金本 彩恵(新潟県立がんセンター新潟病院放射線治療科)
当院におけるBRAVOSの初期使用経験
中嶋 綾(京都大学医学部附属病院放射線治療科)

当院では,婦人科がんに対しCTベースの三次元画像誘導小線源治療(3D-IGBT)を実施しており,2022年4月からバリアン社の高線量率密封小線源治療装置「BRAVOS」が稼働している。3D-IGBTのワークフローはBRAVOS導入の前後で変化はないが,治療計画は放射線治療計画システム「Eclipse」に統合された小線源治療計画装置「BrachyVision」にて行う。
子宮頸がんの腔内照射例におけるBRAVOSの初期使用経験について,BrachyVisionを用いた治療計画を中心に報告する。
BrachyVisionによる治療計画
症例は70歳代,扁平上皮癌FIGO分類ⅢC1r期で,右傍組織浸潤,右閉鎖リンパ節転移があり,シスプラチン併用の同時化学放射線療法を施行した。外照射は全骨盤30.6Gy/17fr,中央遮蔽19.8Gy/11fr,右傍組織・リンパ節へのブースト照射8Gy/4fr,腔内照射は6Gy×4frを実施した。使用したチタン製フレッチャー式アプリケータ(CT/MR対応)は,従来使用していたCT用金属アプリケータと形状がほぼ同じで,MR対応の樹脂製アプリケータと比べてタンデムの挿入部分の径が細いため挿入しやすい。腟浸潤が著明な症例ではタンデムシリンダーを使用している。
治療計画では,別室CT撮影後に画像をEclipseに転送してストラクチャをプラン用とROI用に分割し,診療放射線技師がアプリケータ再構成と定型プラン作成,医師がターゲット描出,物理士がリスク臓器(OAR)描出を同時に行うことで,治療計画の時間短縮を図っている。最後に医師が線量分布評価と最適化を行う。
BrachyVisionではEclipseと同じ操作性でコンツールを行える。ターゲット描出では初回腔内照射直前のMRIを参考にハイリスク臨床標的体積(HR-CTV)を,OAR描出では直腸,S状結腸,小腸,膀胱をコンツールする。アプリケータ再構成では,使用アプリケータをライブラリから選択し,位置自動検出機能を使用するか,画像上でアプリケータをクリックすることでアプリケータモデルが配置される。線源配置では,アプリケータ上で線源配置範囲をドラッグすると停留位置を設定できる。アプリケータ内に挿入したX線マーカの位置と治療計画上の線源位置が一致していることを確認する。
定型プラン作成(図1)では,A点(標的基準点)=6Gyのプランを作成する。Dwell Controlウインドウで線源の停留時間を一定に調節し,A点=6Gyにノーマライズしてプランを作成する。また,Clinical Goalsを設定する機能があり,線量指標を登録しておくと達成状況を可視化できる。本症例は右傍組織浸潤が6Gyラインから少し出る部分(図1→)があったため,Dose Shaper機能を用いて線量分布最適化を行った。調整により,まれに停留時間がある一点だけ極端に長くなる/短くなることが生じるため,最後にDwell Controlウインドウで停留時間を確認して線量分布を確定する。本症例の修正プランでは,6GyのisodoseラインがHR-CTVをカバーできており,D90も7.21Gyと改善している(図2)。プラン完成後は,チェックシートを用いた治療計画の設定などの確認と独立検証ソフトを用いた停留時間の確認を行っている。
BrachyVisionを用いた治療計画は,画像のレジストレーションやコンツールの操作性がEclipseと共通であり,ローテートで研修する若手医師にも使いやすい。また,線量体積ヒストグラム(DVH)指標をClinical Goalsとして設定することで達成の有無を確認でき,Dwell Controlウインドウを確認しながら線量分布を微修正することができる。さらに,外照射プランとの合算が可能な点もメリットで,中央遮蔽の位置の確認や転移リンパ節への積算線量の確認などを容易に行えるため,活用方法について検討していきたい。
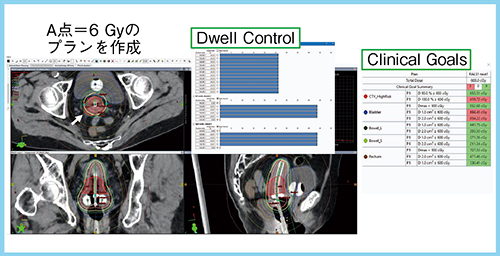
図1 定型プラン作成
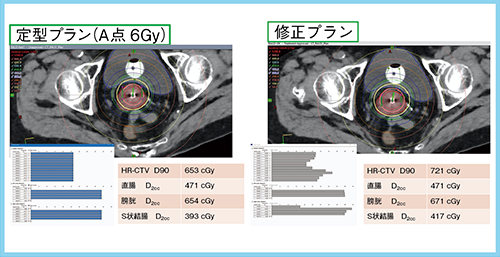
図2 プラン評価
今後の展望
今後の展望として,新しいアプリケータの使用とBrachyVisionのVEGO(Volume Evolutionary Gradient Optimizer)機能の活用を予定している。
BRAVOS導入に伴い新しいアプリケータが導入された。1つは組織内照射併用腔内照射(IC/IS BT)用アプリケータで,オボイドキャップの穴にニードルを通すタイプ(図3 a)とシリンダータイプ(b)の2つがある。今後,これらを用いてIC/IS BTの導入を予定している。もう1つがマルチチャネルシリンダー(図3 c)で,中央だけでなく周囲にもチャネルが配置され,線源を留置することができ,従来よりも粘膜下から少し深い腫瘍に対しても腔内照射が可能である。これらを使用することで,治療成績のさらなる向上や腔内照射の適応拡大が期待される。
また,VEGO機能は,DVHベースの線量最適化が可能で,プライオリティを各ROIに設定することができる。IC/IS BTのような複雑な治療計画においても最適化時間を短縮できると期待される。

図3 新しいアプリケータ
組織内照射を利用する
金本 彩恵(新潟県立がんセンター新潟病院放射線治療科)
当院では,2010年2月にバリアン社の高線量率小線源治療装置「VariSource iX」を導入した。2013年3月に高線量率組織内照射を導入し,組織内照射の症例に限って3D計画を行っていたが,2014年6月からは小線源治療全例で3D計画を開始した。
当院における小線源治療の状況
全例で3D計画を行うようになった2014年6月〜2021年12月の7年半で183人の患者に対して小線源治療を行った。累計の照射回数は634回で,腔内照射が55%,組織内照射/組織内照射併用腔内照射が45%である。
最も症例数の多い子宮頸がん(137人)の治療手技の内訳は,腔内照射単独が53%,組織内照射併用腔内照射が30%,治療中に手技を変更した例が17%であった。治療中に1回でも組織内照射を利用した患者と腔内照射単独で治療した患者の比は,ほぼ1:1であった。
子宮頸がん患者の治療における組織内照射併用の有無を,局所評価因子のT分類別に検討した(図1)。治療症例全体のT分類としてはT2bが最も多く(44人),次いでT1bとT3b(26人)であった。1回でも組織内照射を併用した割合は,T1b:12%,T2a:36%,T2b:41%,T3a:88%,T3b:62%,T4:64%と,T3a以上では半数を超えており,病変の進展範囲が広くなるほど組織内照射の使用例が増加した。また,T3a以上では治療途中に手技変更を行う症例よりも,全治療過程で組織内照射を必要とする症例が多かった。
なお,子宮頸がん以外では,腟がんや子宮頸部・腟再発例に対して組織内照射を主に用いていた。
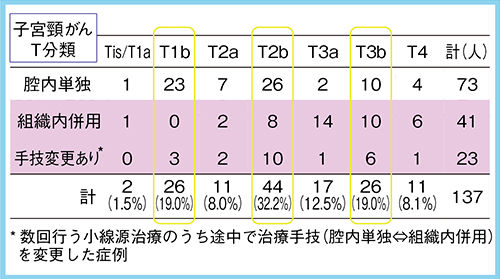
図1 小線源治療手技別の子宮頸がん患者症例数
子宮頸がんに対する組織内照射併用例
1.組織内照射を毎回併用した症例
症例は70歳,女性,T3bN1M0の扁平上皮癌で,化学放射線治療(CRT)にて全骨盤照射(WP)40Gy,中央遮蔽(CS)10Gy,リンパ節転移へのBoost 4Gyに加え,小線源治療18Gy/3回を実施した。原発巣は腟壁,左骨盤壁方向への進展が広くあり,組織内照射を併用した。
小線源治療では,進展している病変部の線量投与を担保するように,局所麻酔下にタンデム,シリンダー,金属針を毎回刺入した。シリンダーを用いることで腟壁病変への線量投与を可能にし,シリンダーに沿って刺入した針や腟壁から刺入した針により左骨盤壁方向へ広がる病変への線量投与を担保した(図2)。本症例は,治療後1年の時点で局所制御は良好である。
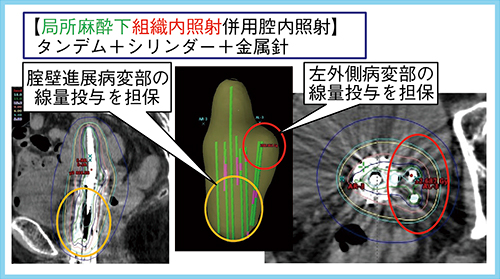
図2 組織内照射を毎回併用した症例
2. 組織内照射併用へ手技変更した症例
症例は79歳,女性,T2bN0M0の扁平上皮癌で,CRTにてWP30Gy,CS20Gyに加え,小線源治療24Gy/4回を実施した。腔内照射単独予定だったが,実際に腔内照射を行ったところ,子宮内腔が予測より左側に位置し,A点処方の線量分布よりも右外側へ線量分布を広げる必要があったことから,2回目からは組織内照射併用とした。その結果,腫瘍への線量投与を満たしつつ,直腸や膀胱への線量を低減した治療が可能となった(図3)。治療後の経過は良好で,治療後約8年が経過した現在も再発はない。
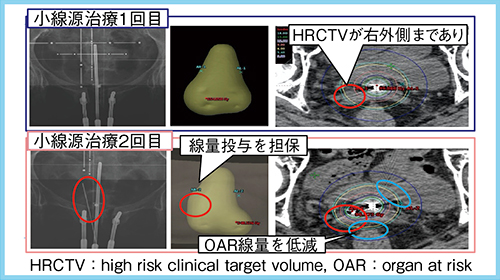
図3 腔内照射から組織内照射併用へ手技変更した症例
3.子宮頸がんT1b〜T4症例の局所評価
3D計画で小線源治療を施行した子宮頸がん137人のうち,当院で外照射を含めた根治的(化学)放射線治療を施行したT1b〜T4症例82人の治療成績について,2D計画時の症例26人の治療成績と比較検討した。
T分類の割合は,3D計画ではT2b(30%),2D計画ではT1bとT3b(31%)が最も多かったが,(3D計画で組織内照射併用の割合が半数以上を占めていた)T3a以上とT2b以下の2群で分けると,その割合は3D計画と2D計画でほぼ同程度であった。
3D計画の治療成績は,経過観察期間中央値23.7か月(2.6〜93.4か月)で2年局所制御率92.2%であった。2D計画の2年局所制御率は83.8%で,有意差はないものの3D計画の方がやや良好であった。
また,治療成績を他施設と比較したところ,3D計画の局所制御率は当院と他施設で著変はなかった。Grade 3以上の晩期合併症(直腸障害,膀胱障害)については,当院では3例(3.6%)に直腸障害を認めたが,この発生率も他施設と同程度であった。
結 語
当院では,3D計画・組織内照射導入後,子宮頸がんT3a以上,腟がん,子宮頸部・再発例に対して組織内照射を多く使用してきた。子宮頸がんについては,3D計画により治療ごとに手技選択や線量分布の作成が可能となり,有意差はないものの局所制御率の向上に貢献できる可能性があると考えている。
BRAVOS アフターローダシステム:医療機器承認番号 30200BZX00305000
ユニバーサルシリンダ アプリケータ 非中心循環系アフターローディング式ブラキセラピー装置アプリケータ:医療機器製造販売承認番号 30200BZX00306000
イントラキャビタリ/インタースティシャル アプリケータ 非中心循環系アフターローディング式ブラキセラピー装置アプリケータ:医療機器承認番号 22500BZX00089000
バリソースiX 非中心循環系アフターローディング式ブラキセラピー装置:医療機器製造販売承認番号 22000BZX00900000
放射線治療計画用ソフトウェア Eclipse:医療機器承認番号 22900BZX00265000
