
ホーム
![]() inNavi Suite
inNavi Suite![]() 東芝メディカルシステムズ
東芝メディカルシステムズ![]() 別冊付録
別冊付録![]() 新。超音波診断 Vol.3
新。超音波診断 Vol.3![]() 心エコーの最新動向
心エコーの最新動向
![]()
心エコーの最新動向
Cardiac Ultrasound Artidaによる心筋の内外分離ストレイン動態評価の臨床応用
瀬尾 由広(筑波大学大学院 人間総合科学研究科 循環器内科 )
2Dスペックルトラッキング法による心筋ストレイン解析
左室壁の収縮期壁厚増加は,全層にわたり一様ではない1)。心室壁を心内膜下層と心外膜下層の2層に分けると,内膜側壁厚増加率(radial strain)は外膜側の1.4〜11倍も大きいと考えられている2)。このように,正常心筋には,内膜側に大きく,外膜側に小さい壁内ストレイン勾配が存在する。この現象は,超音波クリスタルを用いた動物実験において明らかにされた3)。
組織ドプラ法による壁内myocardial velocity gradient(MVG)解析は,ヒトの心臓で初めて壁内ストレイン勾配を評価する手法であった4)。MVG曲線のピークは,正常左室では心内膜下層に位置しており,心筋が虚血に陥ると,MVG曲線のピークは心外膜下層に移動する現象が示された5)。しかし,ドプラ法に内在する角度依存性のため,解析対象領域は傍胸骨像における左室前壁と後壁のみに限られる。そのことが大きな障害となり,MVG解析は日常臨床における虚血診断ツールとして広く普及するに至らなかった。
2Dスペックルトラッキング法は,ドプラ法の持つ角度依存性を克服できる技術であり,すでに心筋壁全層を対象としてradial strain,circumferential strain,longitudinal strainの三次元のストレイン解析が可能となった。複数の論文がvalidationを行い,ストレイン計測精度が臨床的に十分良好であることを報告している6)〜11)。これに基づいて,正常心臓,および病的心臓におけるストレイン解析を行った論文が多数報告され,ヒトにおける心筋ストレイン動態が続々と解明されつつある12)。しかし,これらの研究では,2Dスペックルトラッキング法によるストレインは壁全体を対象として解析しており,壁を内膜側と外膜側に分けて計測する壁内ストレイン勾配の評価はなされていない。
われわれは,超音波クリスタルを用いた動物実験を行い,「Artida」(東芝メディカルシステムズ社製)の2Dスペックルトラッキング法によって心筋を内外分離し,壁内ストレイン勾配が良好な精度で解析可能であることを初めて示した。この方法を用いて,一見壁運動が正常に保たれていると思われる領域においても,ストレイン勾配の異常を検出することができるため,虚血をはじめとする心筋疾患の診断精度が向上することが期待される。さらに,壁内ストレイン勾配の評価は,さまざまな心筋疾患の進展病態の解明に寄与できるかもしれない。
正常臨床例における内膜側/外膜側ストレイン計測
図1に,健常例における内膜側/外膜側ストレイン計測値を示す。計測部位は,冠動脈左前下行枝の灌流領域である心尖部寄りの,左室中部前壁中隔である。図2に示すように,内膜側radial strainは外膜側radial strainよりも有意に大きく,内膜側/外膜側radial strain比は平均で1.5であった。このように,中隔においても,自由壁に見られるような左室内膜下層に大きいストレイン勾配が,ヒトの左室に認められることが示された。
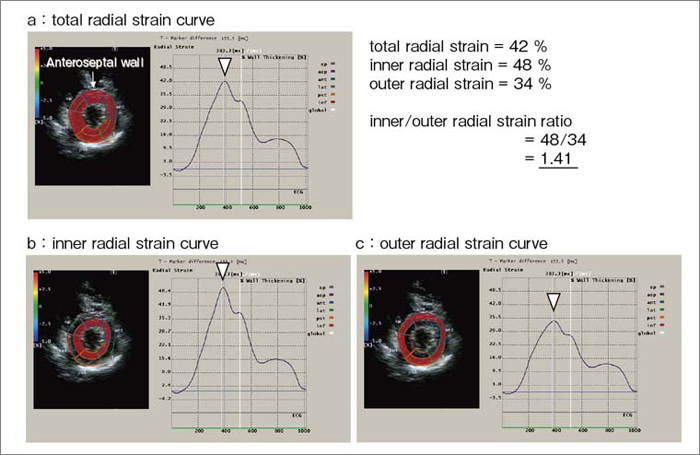
図1 健常例のradial strain 曲線
▽は,左室中部前壁中隔radial strain最大値を示す。aは全層radial srtain,bは内膜側radial strain, cは外膜側radial strainである。内膜側radial strainは外膜側のradial strainより大きく,内膜側/外膜側radial strain比は1.41である。
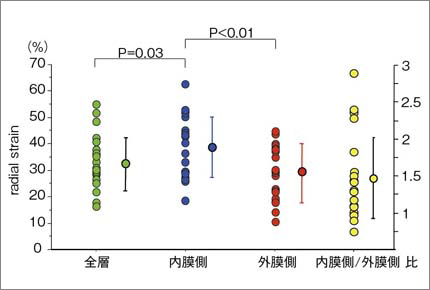
図2 健常例の中部前壁中隔のradial strain
内膜側radial strainは,外膜側radial strainよりも有意に大であった。内膜側/外膜側radial strain 比は平均1.5であった。
虚血性心疾患における臨床応用
心筋虚血による壁運動評価の心エコー診断は容易ではない。現在,壁運動評価の最も信頼できる方法は,熟練した検者が局所壁厚が増加しているかどうかを視認する主観的な判断である。動物実験では,冠動脈を徐々に結紮すると,内膜下心筋の冠血流量に比例して,全層の壁厚増加が直線的に低下する13)。したがって,壁運動の低下は,内膜下心筋血流量の良い評価法となるはずである。ところが,臨床的には冠血流が低下している症例でも,壁運動の低下を診断できないことが少なくない。図3は,救急病院での不安定狭心症における冠動脈造影所見と,心エコーによる虚血領域の壁運動評価の関係である。心臓カテーテル検査で末梢血流遅延を伴い,明らかに冠血流量が低下している65例のうち23例で壁運動が低下しているものの,22例(30%)において壁運動異常は視認されなかった。また,20例では心エコー自体が行われていないか,行っても画質不良で判定不能であった。このように,実臨床では,不安定狭心症の急性期の虚血診断に,心エコー壁運動評価はあまり当てにならない。
虚血性変化は,心内膜下層に始まり,重症になるにつれ心外膜側へ及ぶ。Wavefront現象と呼ばれるこの心筋虚血進展様式は,イヌの心臓で提唱された理論である14)。イヌは生来,心外膜側の側副血行の発達が非常に良好な種であり,当初,この説がヒトに当てはまるか異論があった。しかし,病理組織学的方法やMRI遅延造影法によって,ヒトでもこの理論が多くの症例で当てはまることが確認され,現在では虚血性変化の特徴として異論のないところである。内膜下層心筋が虚血の影響を受けやすい理由は,内膜下層では外膜下層に比べ,心筋酸素需要が大きいこと,冠動脈血流予備能が小さいこと,冠灌流の下流に存在することなどが考えられている。いずれにしても,虚血性壁運動異常の検出は,全層を対象として壁運動を評価するよりも,虚血に敏感な心内膜下層の壁運動を評価する方が,より軽症な異常の診断ができると予想される5)。
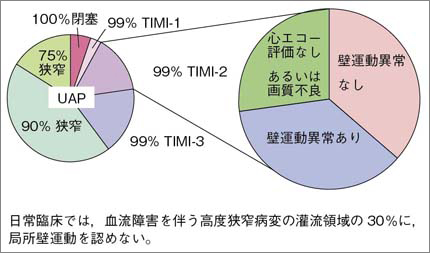
図3 不安定狭心症例の責任冠動脈狭窄率と99%狭窄病変に造影遅延を伴う群における心エコー壁運動評価
2007年4月〜2008年2月までに筑波メディカルセンター病院を受診した不安定狭心症212例のうち,造影遅延を有する99%狭窄の受診時心エコー壁運動評価。日常臨床では,壁運動異常なしと判定した領域が,冠動脈造影で造影遅延を伴う血流障害を有していることが稀ではない。
図4は,不安定狭心症の54歳,男性の2Dスペックルトラッキング解析画像である。本症例は,非典型的な安静時前胸部違和感を主訴に医療機関を受診した。心電図では前胸部誘導にST-T変化を認めるものの(図5),血液学的検査では心筋逸脱酵素の上昇はなく,心エコーでは明らかな左室局所壁運動異常は認められなかった。ところが,冠動脈造影では,左前下行枝近位部に99%高度狭窄病変と,末梢の造影遅延を認めた(図6)。冠動脈末梢の造影遅延は,冠血流量が低下していることを示す所見である。図4aに示す前壁中隔の全層radial strainは39%であり,図2の健常例の分布内に含まれる。また,同一症例のほかのセグメントのストレイン曲線とも大きな差異は認められない。ところが,図4 bに示すように,左前下行枝領域の内膜側radial strainは,カラー表示で青色で示され,ストレイン値は−3%と低値である。この結果,内膜側/外膜側radial srain比は非常に低値となった。これは,左前下行枝の灌流領域に一致する心内膜下収縮不全を検出している可能性がある。
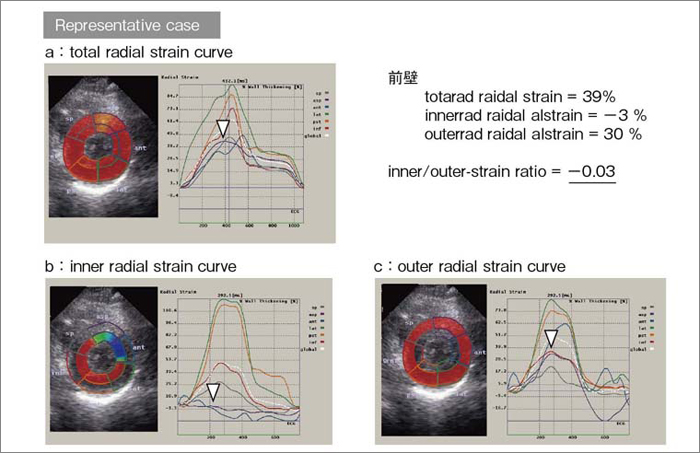
図4 左前下行枝の高度狭窄例のradial strain 曲線(54歳,男性,不安定狭心症)
▽は,中部前壁中隔radial strain最大値を示す。aは,全層radial strain,bは内膜側radial strain,cは外膜側radial strainである。bでは,内膜側radial strainは低下し,外膜側のradial strainより小さく,内膜側/外膜側radial strain比は-0.03である。
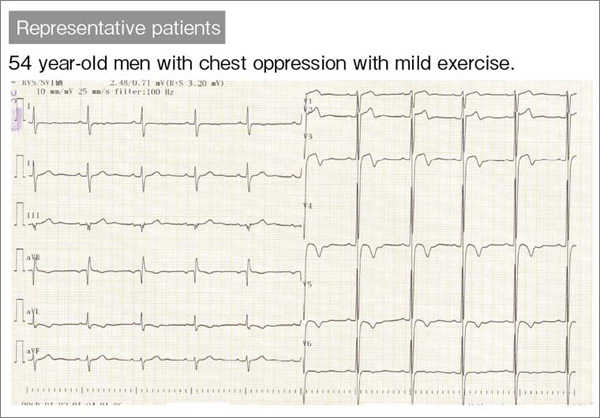
図5 図4の症例の心電図
非特異的ST-T変化を認める。
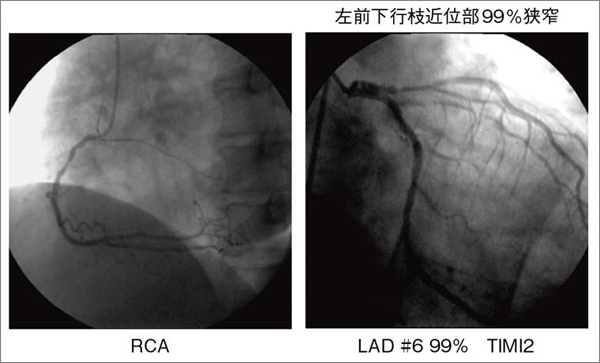
図6 図4の症例の冠動脈造影所見
左前下行枝近位部に末梢の造影遅延を伴う99%狭窄を認める。
さらに,壁運動異常を視認できない左前下行枝近位部の高度狭窄4例について,中部前壁中隔のストレインを解析し,健常10例と比較した。全層radial strainは正常群と差を認めなかったものの(図7),内膜側radial strainは狭心症群で正常群よりも有意に小さく(図8 左),外膜側radial strainは狭心症群で健常群よりも有意に大であった(図8 右)。また,内膜側/外膜側radial strain比は有意に小となった(図9)。このことから,内膜側radial strainは,虚血性心筋収縮異常を鋭敏に反映する可能性がある。また,虚血による心筋収縮動態において,内膜側の壁厚増加不良を外膜側の過収縮により代償し,全層の壁厚増加が保たれる機序を示唆する所見であると考えられる。
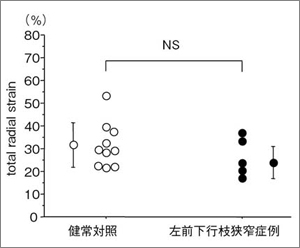 図7 前壁中隔の全層radial strain 視覚的に壁運動異常を示さない例を対象に検討しており, 全層radial strainは,前下行枝狭窄症例も健常例と差を認めない。 |
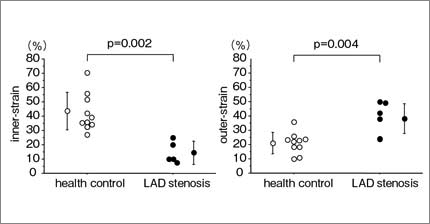 図8 前壁中隔の内膜側radial strain(左),外膜側radial strain(右) 狭心症群は健常群に比べ,内膜側radial strainは有意に小さく,外膜側radial strainは有意に大きかった。 |
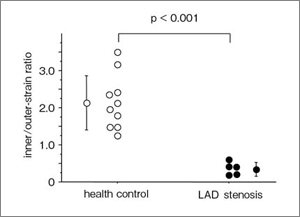
図9 前壁中隔の内膜側/外膜側radial strain 比
狭心症群は健常群に比べ,内膜側/外膜側radial strain比は有意に小さかった。
まとめ
2Dスペックルトラッキング法による内外分離ストレイン解析は,視認することが不可能な壁内ストレイン勾配を検出しうる,非侵襲的画像診断法である。本法を用いた壁内ストレイン勾配解析は,虚血の診断精度の向上をはじめ,各種心疾患における心筋障害の病態の解明をもたらす診断ツールとしての可能性を秘めており,今後の研究成果が大いに期待される。
| ●参考文献 | |
| 1) | Cheng, A., Nguyen, T.C., Malinowski, M., et al. : Heterogeneity of left ventricular wall thickening mechanisms. Circulation, 118, 713〜721, 2008. |
| 2) | Cheng, A., Langer, F., Rodriguez, F., et al. : Transmural cardiac strains in the lateral wall of the ovine left ventricle. Am. J. Physiol. Heart. Circ. Physiol., 288, H1546〜1556, 2005. |
| 3) | Gallagher, K.P., Stirling, M.C., Choy, M., et al. : Dissociation between epicardial and transmural function during acute myocardial ischemia. Circulation, 71, 1279〜1291, 1985. |
| 4) | Derumeaux, G., Ovize, M., Loufoua, J., et al. : Assessment of nonuniformity of transmural myocardial velocities by color-coded tissue doppler imaging ; Characterization of normal, ischemic, and stunned myocardium. Circulation, 101, 1390〜1395, 2000. |
| 5) | Kuwada, Y., Takenaka, K.: Transmural heterogeneity of the left ventricular wall ; Subendocardial layer and subepicardial layer. J. Cardiol., 35, 205〜218, 2000. |
| 6) | Amundsen, B.H., Helle-Valle, T., Edvardsen, T., et al. : Noninvasive myocardial strain measurement by speckle tracking echocardiography ; Validation against sonomicrometry and tagged magnetic resonance imaging. J. Am. Coll. Cardiol., 47, 789〜793, 2006. |
| 7) | Artis, N.J., Oxborough, D.L., Williams, G., et al. : Two-dimensional strain imaging: a new echocardiographic advance with research and clinical applications. Int. J. Cardiol., 123, 240〜248, 2008. |
| 8) | Korinek, J., Wang, J., Sengupta, P.P., et al. : Two-dimensional strain--a Doppler-independent ultrasound method for quantitation of regional deformation ; Validation in vitro and in vivo. J. Am. Soc. Echocardiog., 18, 1247〜1253, 2005. |
| 9) | Langeland, S., D’Hooge, J., Wouters, P.F., et al. : Experimental validation of a new ultrasound method for the simultaneous assessment of radial and longitudinal myocardial deformation independent of insonation angle. Circulation, 112, 2157〜2162, 2005. |
| 10) | Pirat, B., Khoury, D.S., Hartley, C.J., et al. : A novel feature-tracking echocardiographic method for the quantitation of regional myocardial function ; Validation in an animal model of ischemia-reperfusion. J. Am. Coll. Cardiol., 51, 651〜659, 2008. |
| 11) | Reant, P., Labrousse, L., Lafitte, S., et al. : Experimental validation of circumferential, longitudinal, and radial 2-dimensional strain during dobutamine stress echocardiography in ischemic conditions. J. Am. Coll. Cardiol., 51, 149〜157, 2008. |
| 12) | Dandel, M., Hetzer, R.: Echocardiographic strain and strain rate imaging--clinical applications. Int. J. Cardiol., 132, 11〜24, 2009. |
| 13) | Gallagher, K.P., Osakada, G., Matsuzaki, M., et al. : Nonuniformity of inner and outer systolic wall thickening in conscious dogs. Am. J. Physiol., 249, H241〜248, 1985. |
| 14) | Reimer, K.A., Lowe, J.E., Rasmussen, M.M., et al. : The wavefront phenomenon of ischemic cell death. 1. myocardial infarct size vs duration of coronary occlusion in dogs. Circulation, 56, 786〜794, 1977. |