
ホーム
![]() inNavi Suite
inNavi Suite![]() 日立メディコ
日立メディコ![]() 別冊付録
別冊付録![]() 磁遊空間 Vol.24
磁遊空間 Vol.24![]() ECHELON Vegaを用いたDWIによる前立腺がんの新しい病変表示方法 山添 真治 東京慈恵会医科大学附属柏病院放射線科(現・東京歯科大学市川総合病院放射線科) 清水勧一朗/大内厚太郎/松井 洋/最上 拓児/原田 潤太 東京慈恵会医科大学附属柏病院放射線科
ECHELON Vegaを用いたDWIによる前立腺がんの新しい病変表示方法 山添 真治 東京慈恵会医科大学附属柏病院放射線科(現・東京歯科大学市川総合病院放射線科) 清水勧一朗/大内厚太郎/松井 洋/最上 拓児/原田 潤太 東京慈恵会医科大学附属柏病院放射線科
![]()
PICK UP
ECHELON Vegaを用いたDWIによる前立腺がんの新しい病変表示方法
山添真治〔東京慈恵会医科大学附属柏病院放射線科(現・東京歯科大学市川総合病院放射線科)〕
清水勧一朗/大内厚太郎/松井 洋/最上拓児/原田潤太 (東京慈恵会医科大学附属柏病院放射線科)
前立腺は加齢とともに肥大し,50歳以上の男性の約半数が前立腺肥大症に罹患すると言われる。また,高齢者で最も重要な疾患として前立腺がんが挙げられる。男性のがんの約10%を占め,年々罹患率は増加傾向であり,2020年頃には男性のがんの中で2番目に多い疾患になることが予想されることから,早期発見はますます重要になっている。
われわれは,拡散強調画像(diffusion weighted image:DWI)での骨盤底部の信号強度を指標として,これに対する標準偏差を計算することにより,腫瘍範囲を推定する手法〔相対的信号強度(relative signal intensity:rSI)〕を報告した。本稿では,この新しいDWIの表示方法を中心に述べ,今後の展望についても述べる。
前立腺とは
前立腺は,男性の内生殖器の外分泌腺として機能している。大きさは約3cm大,約20〜30mLである1)。前立腺液を分泌し,精液の約30%を占める1)。作用としては,主に精液の液化と殺菌効果が挙げられる1)。また,前立腺液は弱アルカリ性であり,腟内環境(弱酸性)での精子の活動性に関与している1)。前立腺の構成としては,約70%を腺組織が占めている2)。辺縁域(PZ),移行域(TZ),中心域(CZ),少量の内尿道周囲域(PUT)に分かれており,一般的に内腺と呼ばれる領域にTZとPUT,外腺と呼ばれる領域にPZとCZが相当する2)。尿道はTZを貫いて走行し,射精管はCZを貫いて尿道に開口している(図1)2)。
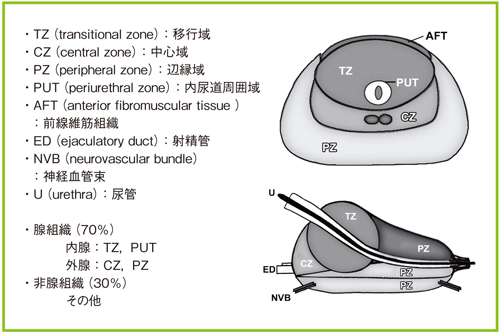
図1 前立腺の解剖(参考文献2)より引用転載)
前立腺は加齢とともに変化する。CZは腺組織の約25%を占めているが,加齢とともに萎縮が始まり小さくなる3)。TZは逆に,本来5%程度しか占めていないが,加齢とともに増大し,前立腺肥大症の発生母地となっている3)。PZは腺組織の約70%を占めており,主な腺組織であるが,TZの肥大とともに側後方へ圧排され,菲薄化されていく3)。
前立腺がんは,主にPZ(60%以上)とTZ(約30%)から発症すると言われており,CZから前立腺がんが発症することは稀である1)。
前立腺がんの画像診断
前立腺の画像診断はMRIが有用である。正常の場合,PZがT2強調画像において高信号として描出される1),3)。CZおよびTZは,T2強調画像において低信号,もしくはモザイク状の信号を呈する1),3)。そのため,CZおよびTZを画像上見分けることは困難である。
PZの前立腺がんは,T2強調画像において高信号の腺組織の中に低信号結節として存在し,比較的検出しやすい。しかし,TZやCZではT2強調画像にてモザイク信号となるため,前立腺がんの検出は困難である。そのためDWI,特に見かけの拡散係数(apparent diffusion coefficient:ADC)マップやダイナミック造影MRIが,前立腺がんの検出率向上のために撮像される1),3)。前立腺がんは拡散の低下を伴うため,ADCマップでは低信号として,ダイナミック造影MRIでは早期造影およびwashout像として描出される1),3)。しかし,DWIは装置の性能やb値を含めた撮像条件に左右され,造影MRIは造影剤注入からの撮像タイミングに左右される。そのため,個々の施設や装置に合わせた撮像条件設定が重要となる。
当院における前立腺に対する画像診断
図2 日立メディコ社製 1.5T MRI
「ECHELON Vega」

表1 当院における前立腺MRI撮像プロトコール
前立腺がんの画像診断においてはMRIが有用とされており,特にDWIを用いる際,ADCマップの有用性が報告されている。しかし,ADCマップは原理的に,2つ以上のb値から計算されるために潜在的な不一致の懸念があり,また,信号雑音が強く,診断に苦慮する場合がある。もし,DWIの信号強度そのものが使用できれば,このような問題は解決可能である。
最近,肺腫瘍において,腫瘍の脊髄神経に対する相対信号強度が,ADCマップよりも有用であったことが報告された4)。しかし,この手法は骨盤には使用できない。なぜならば,指標となる標準的信号強度を示す適切な臓器が撮像面内にないからである。そこで当院では,DWIでの骨盤底部全体の信号強度を指標として,これに対する標準偏差を計算することにより腫瘍範囲を推定する手法〔相対的信号強度(relative signal intensity:rSI)〕を導入した。実際には,このrSIとT2強調画像をフュージョンした“Fusion rSI”を用いて,日常の前立腺画像診断を行っている。
使用MRI装置は日立メディコ社製1.5T「ECHELON Vega」(図2),使用コイルは8channel passed-array body coilである。当院における前立腺MRI撮像プロトコールを表1に示す。造影MRIのプロトコールが組まれてはいるが,現在はほぼ造影検査は行っておらず,専らDWI,特にFusion rSIにて診断を行っている。DWIは撮像時間の問題や,複数のb値の撮像を同時に行えないことから,単一b値の撮像となっている。b値の設定に関しては文献上,b値が1000以上であれば正常前立腺の信号抑制が良好になると言われており,特にb値2000ではがんの検出能は向上するものの,ADCマップでの評価が難しくなると報告されている。DWI画像で評価する場合は,b値を1000〜2000で設定するのが望ましいと考える。そのため,当院ではb値1500にてDWIを撮像しているが,加算回数は約24回になるよう設定し,DWIがより明瞭なものとなるようにした。また,FOV,スライス厚およびスライスギャップはT2強調画像と同様の条件とすることで,簡便で正確なT2強調画像とDWIのフュージョン画像(Fusion rSI)の作成を可能にしている。なお,上記条件の設定はECHELON Vegaにおいてのものであり,他社の装置ではその限りではない。
Fusion rSI
DWIにおける評価の欠点は,DWIでの高信号のとらえ方に主観が入りやすいことにある。また,同条件で撮像を行っても,コントラストを変えるだけで別の画像のように見える危険性がある。しかし実際に,画像上では信号の「高・低」が確実に存在しており,信号強度は数値として記録されている。そこで,われわれはDWIの信号強度を客観的に評価する方法として,骨盤底部のDWIの信号強度を計算し標準偏差で評価するとともに,T2強調画像にフュージョンするソフトウエアを開発した(図3)。DWIには人体以外の領域も含まれているため,骨盤外の信号が入らないように,骨盤底部にROIを設定した。これにより,開発したソフトウエアは,ROI内のDWI信号強度の標準偏差を自動で算出し,自由に設定したSD値以上の信号のみを描出できる。SD値の設定は0.1から変更可能であり,3SD,3.5SD以上のFusion rSI画像を作りたい場合は,SDの値を変更するだけで表示変更が可能である。
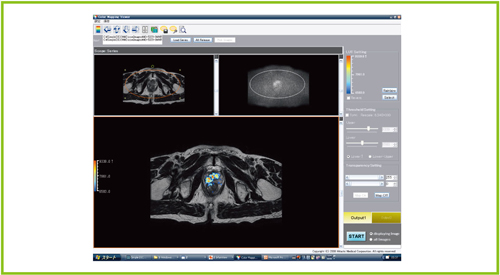
図3 開発したソフトウエア
図4は,前立腺がんの症例である。DWIでは高信号域を認めるが,解剖学的構造が不明瞭で,正確な位置の評価は困難である(図4b)。しかし,Fusion rSI(>3SD)では病変を明瞭に描出できており,解剖学的な位置の特定が容易である(図4c)。さらに,T2強調画像(図4a)で不明瞭であった小さな左TZの病変も,Fusion rSIでは描出できている(図4c)。また,本症例では,Fusion rSI上,その他の小さな高信号が直腸内に重なって見られる。そのため,前立腺がんの診断においては,T2強調画像にて低信号を示す部位で,かつrSIで高信号となる領域を評価するのが望ましいと考える。
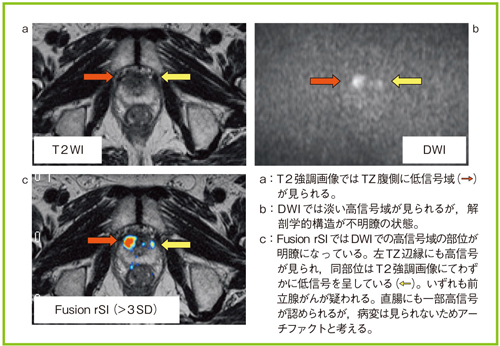
図4 従来のDWIとFusion rSIの比較(前立腺がん症例)
図5は,さまざまなSD値におけるFusion rSIの比較であるが,SD値を変えることで描出範囲が変化し,SD値が高くなるにつれて描出範囲が小さくなっていることがわかる。
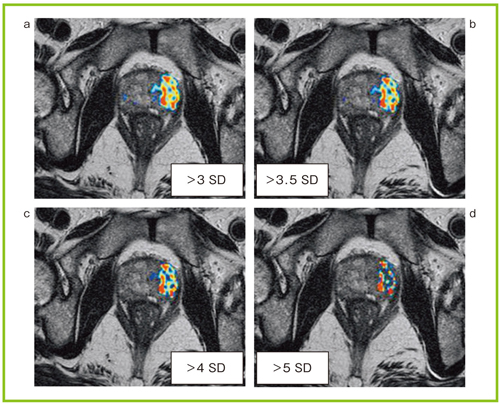
図5 Fusion rSIのSD値による描出能の比較
そこで,われわれは,前立腺MRIを撮像した症例のうち,前立腺全摘出術を施行し,前立腺がんが証明された17例の検討を行った。Fusion rSI>3SD,>3.5SD,>4SD,>5SDの4つの画像と病理割面との比較を行ったところ,Fusion rSI>3.5SD以上の画像では一部の症例でがん病変を描出できなかったが,>3SDのFusion rSIでは,すべての症例で病変を描出することができた。病理割面および画像スライス上の前立腺全体に対するがん病変の面積比の比較では,Fusion SI >3SD,>3.5SD,>4SDにおいて良好な相関性が得られた〔Yamazoe, S., et al. : Magn. Reson. Med. Sci., 11・1,1〜8, 2012(in press).参照〕。
Fusion rSIのメリットとデメリット
最大のメリットは,DWIの高信号域を客観的に評価できることである。DWIの高信号域がFusion rSIではカラー表示されるため,病変の評価も簡便となるほか,T2強調画像とのフュージョンにより,解剖学的弱点も克服できている。さらに,撮像範囲内の骨転移やリンパ節転移もDWIにて高信号となるため,同時に描出することができる(図6)。また,Fusion rSI画像の作成は5分以内であり,時間的負担が少ないのもメリットの1つである。
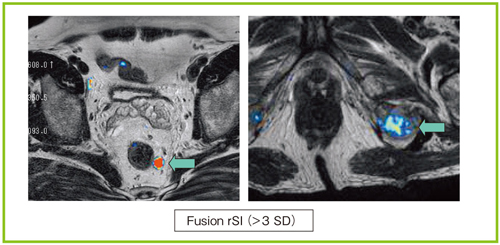
図6 Fusion rSIによる病変検出
リンパ節転移,骨転移病変も描出できる。
一方で課題もいくつかある。1つ目は,少なからず直腸のガスによるアーチファクトが生じることである。事前に直腸ガスを脱気したり,直腸コイルを併用する手段もあるが,患者への負担や手間などを考慮すると,実臨床での使用はなかなか難しいと考える。2つ目は,がんの大きさが4mm以下の場合や,グリソンスコアが6未満の場合では,描出が困難なことである。つまり,小さな腫瘍の場合,Fusion rSIで点状に描出されていても,残存するアーチファクトとの識別が困難となることが多い。3つ目は,骨盤内を占拠するような巨大な前立腺がんの場合,Fusion rSIでは高信号域が大半を占めることになるため,相対的にがんの描出領域が小さくなってしまうことである。そのため,Fusion rSIは前立腺内に比較的限局した前立腺がんの描出に向いていると考える。
Fusion rSIの今後の展望
Fusion rSIは前立腺がん局在の描出に優れるため,この画像をガイドにして前立腺のtarget biopsyや,高度医療としての凍結治療が可能となることが期待される。しかし,これらの手技を行うためにはMRIのみでは困難と思われ,前立腺がんの小線源治療のように,経直腸超音波との併用が必要と考える。今後は,前立腺生検の感度の向上や,より非侵襲的な局所治療に貢献できれば良いと考えている。
まとめ
Fusion rSIは,前立腺がんの描出において,3SD以上でのrSI画像が病理肉眼像と相関し,有用と考えられる。ただし,小さな病変や,グリソンスコアの低い症例では描出が困難な場合があるため,注意を要する。今後はこの画像をガイドとして,前立腺生検や前立腺がんの局所治療への応用が可能と考えている。
| ●参考文献 | |
| 1) | 伊藤博敏,西田香織,西村恒彦:前立腺の解剖とMRIによる描出. 画像診断,東京,秀潤社,29・12,1366〜1373,2009. |
| 2) | Choi, Y.J., Kim, J.K., Kim, N., et al. : Functional MR imaging of prostate cancer. RadioGraphics, 27, 63〜77, 2007. |
| 3) | 山下康行(編著):知っておきたい泌尿器のCT・MRI.東京,秀潤社,200〜209,2008. |
| 4) | Uto,T., Takehara, Y., Nakamura, Y., et al. : Higher sensitivity and specificity for diffusion-weighted imaging of malignant lung lesions without apparent diffusion coefficient quantification. Radiology, 252, 247〜254, 2009. |
| 5) | Lim, H.K., Kim, J.K., Kim, K.A., et al. : Prostate cancer; Apparent diffusion coefficient map with T2-weighted images for detection—a multireader study. Radiology, 250, 145〜151, 2009. |
| 6) | Langer, D.L., van der Kwast, T.H., Evans, A.J., et al. : Intermixed normal tissue within prostate cancer;Effect on MR imaging measurements of apparent diffusion coefficient and T2—sparse versus dense cancers. Radiology, 249, 900〜908, 2008. |
| 7) | Jacobs, M.A., Ouwerkerk, R., Petrowski, K., et al. : Diffusion-weighted imaging with apparent diffusion coefficient mapping and spectroscopy in prostate cancer. J, Magn, Reson, Imaging, 19, 261〜328, 2008. |
| 8) | Haider, M.A., van der Kwast, T.H., Tanguay, J., et al. : Combined T2-weighted and diffusion-weighted MRI for localization of prostate cancer. Am, J, Roentgenol., 189, 323〜328, 2007. |