セミナーレポート(キヤノンメディカルシステムズ)
一般社団法人日本心エコー図学会第30回学術集会が2019年5月10日(金)〜12日(日)の3日間,松本キッセイ文化ホール(長野県松本市)にて開催された。11日(土)に行われたキヤノンメディカルシステムズ株式会社共催ランチョンセミナー5では,国立循環器病研究センター病院心臓血管内科部門心不全科部長の泉 知里氏が座長を務め,山口大学医学部附属病院検査部講師の和田靖明氏と,同院超音波センターの有吉 亨氏が,「そうだ! Aplio i900を使ってみよう!!」をテーマにレクチャー&ライブデモを行った。ここでは,和田氏のレクチャーを中心に報告する。
2019年8月号
一般社団法人日本心エコー図学会第30回学術集会ランチョンセミナー5
そうだ! Aplio i900を使ってみよう!!─レクチャー&ライブデモ─
和田 靖明(山口大学医学部附属病院検査部)
超音波診断装置においては近年,循環器領域の検査に有用な新機能が多数登場している。本セミナーでは,当院が2018年に導入したキヤノンメディカルシステムズ社製超音波診断装置「Aplio i900」に搭載されている日常臨床に役立つ機能を,レクチャー&ライブデモ形式で紹介する。

座長:泉 知里氏 |

ライブデモ: |
断層心エコー法を用いた左室容積計測:biplane disk summation法
心エコーで左室駆出率(EF)や左室容積を計測するために,心尖部四腔断面(4 chamber view)と心尖部二腔断面(2 chamber view)を利用して左室容積を求めるbiplane disk summation法が用いられる(図1)。また近年,各メーカーの超音波診断装置に自動でEFを計測する機能(キヤノンメディカルシステムズ社では“Auto EF”)が採用され,超音波画像の画質向上とともに精度が向上している。
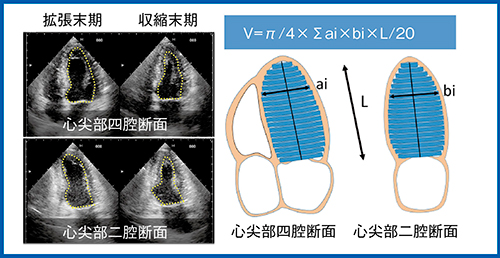
図1 Biplane disk summation法の原理
biplane disk summation法で左室容積計測を行うには,通常,4 chamber viewと2 chamber viewを,それぞれ拡張末期,収縮末期で合計4回トレースするため非常に手間がかかる。一方,実臨床においては,EFあるいは左室容積の計測のために全症例にbiplane disk summation法を行っている施設が多いと思われる。ここでは,ライブデモにて,Aplio i900によるbiplane disk summation法での左室容積計測のポイントや,Auto EFの特長などを紹介する。
Aplio i900によるライブデモの様子
【ライブデモのポイント】
- 心尖部にプローブを当て,まず呼気時に2 chamber viewに合わせてから4 chamber viewに合わせると,きれいな4chamber viewが得られやすい。
- 側壁が描出しづらい症例でも,Aplio i900はラテラルゲインが調整可能であるため,ラテラルゲインを上げると側壁が明瞭に描出される。
- 4chamber viewと2chamber view が明瞭に描出されていれば,ナレッジベースの機能であるAuto EFを用いて,わずか10秒程度でEFを計測可能。
- Auto EFでトラッキングの精度が不十分な場合は,拡張末期に弁輪部および心尖部の3点を設定すれば,拡張末期,収縮末期共にセミオートで高精度にトレースされる。
Biplane disk summation法によるGLSの算出
Aplio i900では,biplane disk summation法で左室容積計測を行うと,EFなどに加えてglobal longitudinal strain(GLS)が表示される(図2□:症例1)。GLSを算出する従来の手法である2D Wall Motion Tracking(WMT)(図3 b,図4)では,心内膜のラインを細かく等分し,それぞれの点の長さの変化の合計でストレインを算出する。一方,biplane disk summation法(Auto EF計測)によるGLS(図3 a)は,心内膜のトレースラインの長さの変化をストレインとして算出している。そして,4 chamber viewと2 chamber view双方の平均値から左室GLSが算出される。
症例1について,上記の2つの手法で求めたGLSの値を比較すると,いずれも18.9%であった(図5)。いずれの方法でもかなり近似した値が算出されるが,本症例は壁運動異常がないことに注意する必要がある。
上記の注意点を踏まえた上で,例えば化学療法前に,心筋障害を起こすかどうかがわからない段階で全症例に2D WMTによるGLS計測を行うのは躊躇するような場合でも,簡単なbiplane disk summation法での計測を行っておき,EFに加えてGLSが算出されれば,化学療法後のフォローアップに有用となる可能性がある。当院では現在,biplane disk summation法でのGLSの数値がどの程度であれば,2D WMTによるGLSの計測を追加すべきかを検討中である。
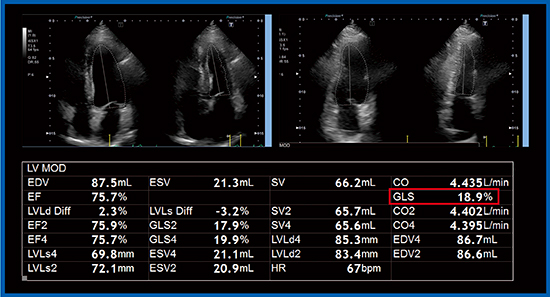
図2 Biplane disk summation法によるGLSの算出(症例1)
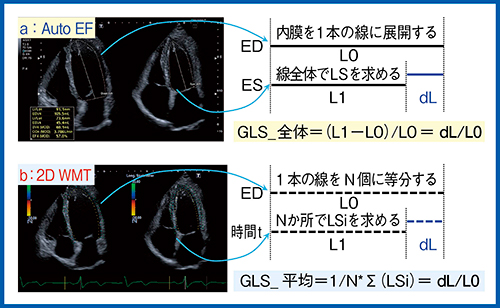
図3 Auto EFと2D WMTによるGLSの算出方法
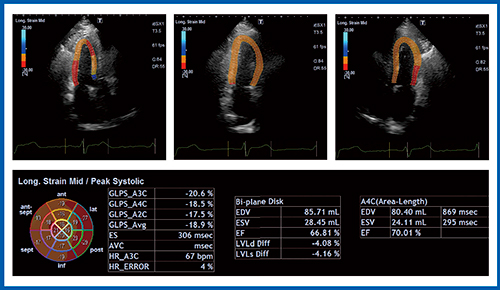
図4 2D WMTの解析画面

図5 Biplane disk summation法と2D WMTによるGLSの比較
1.2D WMT
ライブデモでは,Aplio i900による2D WMTの精度や簡便性を紹介する。
【ライブデモのポイント】
- Aplio i900は,オフラインはもとよりオンラインでの2D WMT解析が簡便,迅速,高精度に実施できるため,当院では化学療法前後の症例のフォローアップや心アミロイドーシスの評価に用いている。
- 2D WMT解析では,まず4 chamber viewを描出してフリーズし,その後2回クリックするだけで,数秒程度でトラッキングが終了する。トラッキング精度はきわめて良好であり,修正もほぼ不要である。2 chamber view,3 chamber viewも同様の操作を行う。
- 心尖部が不明瞭な症例ではトラッキングは困難であるが,装置側ではなんとか追従しようとするため,きちんと追従できていない部分は除外して解析を行うことも可能である。
- polar mapやレポート形式での解析結果表示も短時間で可能である。
2.3D WMT
キヤノンメディカルシステムズ社の超音波診断装置には,3D WMTも搭載されている(図6)。ライブデモでは,3D WMTによるGLS解析を紹介する。
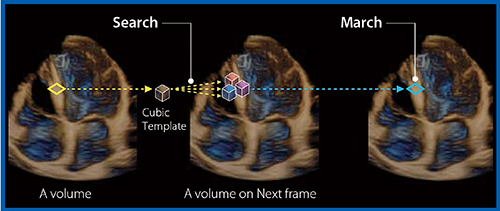
図6 3D WMTの概要
【ライブデモのポイント】
- 同社の3Dプローブは,2Dプローブと遜色のない大きさにまで小型化され,使いやすくなっている。
- 3D WMTでは,2 chamber view,4 chamber viewを合わせてから心尖部を描出するが,3Dのため厳密に合わせる必要はない。multi-planeで全体像が描出されている箇所で画像を取り込む。speckle trackingはボタン1つで可能であり,GLSがいとも簡単に算出される。
ドプラ法による心拍出量の計測
ドプラ法にて心拍出量を計測するに当たり,左室駆出血流の速度波形から速度時間積分値(VTI:cm)を算出する。この時,トレースの方法として,血流速度波形の濃い辺縁の部分をトレースするよう注意する(図7左↓)。ライブデモでは,トレースに有用なAplio i900の機能を紹介する。
【ライブデモのポイント】
- Aplio i900にはオートトレース機能が搭載されているため,非常に便利であるが,オートトレースがしづらい症例については手動でトレースすることとなる。Aplio i900の場合,手動で波形の辺縁に複数の点を設定すると,適切なラインでトレースされる“splineトレース”という機能が搭載されている。オートトレースより若干時間はかかるものの,トラックボールで完全に手動でトレースするよりは断然速く,きれいにトレースできる。
- 左室流出路の断面積とVTIから1回拍出量(SV)を算出し,SVに心拍数を掛けて心拍出量を算出するが(図7),その前に,カラードプラを用いて左室流出路血流に偏移がなく,評価に値するカラー分布であるかどうかを確認する。大動脈弁は上下運動を行っているため,パルスドプラのカーソルは,拡張末期の大動脈弁の辺りの位置に置くとよい。パルスドプラ波形では,収縮期には弁のノイズがなく,拡張早期に大動脈弁によるノイズが出ていることが指標になる。
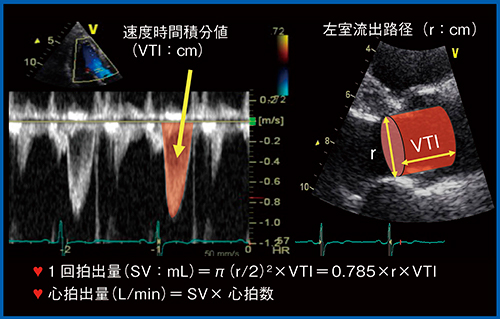
図7 ドプラ法による心拍出量の計測
症例提示
症例2は,50歳代,男性。左前下行枝の急性心筋梗塞(AMI)に対する経皮的冠動脈インターベンション(PCI)後2週間の症例である。Aplio i900にて,心尖部領域の広範囲に壁運動異常が認められ,同部位に壁在血栓を疑う像が確認できたが,自信を持って血栓と診断できない(図8 a)。このような時には,リニアプローブを用いることで,心尖部の壁の薄くなった領域と血栓の状態がより明確に判断できる(図8 b)。
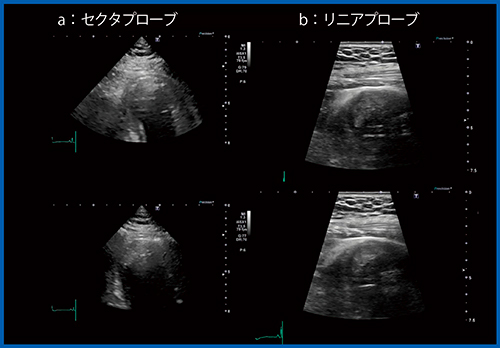
図8 症例2:セクタおよびリニアプローブによる左室壁在血の描出
(AMI,PCI後2週間の症例)
症例3は,70歳代,女性。がん治療関連心筋障害(CTRCD)により,びまん性左室壁運動低下が出現し,心尖部に比較的輝度の高い異常構造物を認めたが,周囲の肉柱様構造物ならびに多重反射の影響で明瞭な画像描出は困難であった(図9 a)。リニアプローブでは心尖部の内腔の状態が明瞭に描出され,可動性心尖部血栓を容易に描出できている(図9 b)。
ライブデモでは,リニアプローブによる心尖部領域の描出のポイントを紹介する。
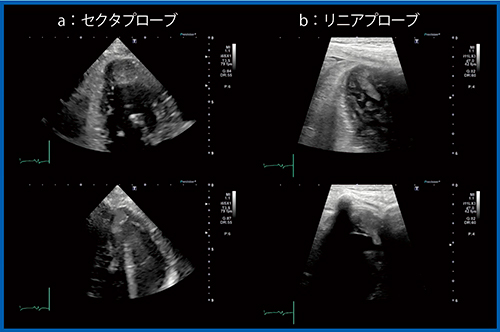
図9 症例3:セクタおよびリニアプローブによる心尖部の血栓の描出(CTRCD症例)
【ライブデモのポイント】
- ここでは,Aplio i900における心臓を対象としたリニアプローブのプリセットの設定を紹介する。まず,ルーチンの頸動脈検査の設定を立ち上げ,深度を下げて心尖部を描出する。当然,描出は不十分であるが,コンパウンドを切ることで鮮鋭度が向上する。また,心臓が見やすくなるようWideViewを使用してエコーウインドウを広げ,画角を狭めてフレームレートを40fpsに上げ,周波数を若干下げて深部が描出されるように設定し,息止め下で撮像する。このようにすることで,心尖部の肉柱までしっかりと描出される。
- 上記の設定は,心尖部の血栓を疑う症例や心尖部肥大の小さな瘤の描出,冠動脈の描出にも有用である。また,心膜の癒着が疑われるような血行動態の症例も,リニアプローブを用いることで心膜の状況を評価しやすい。

和田 靖明(Wada Yasuaki)
1997年 鳥取大学医学部医学科卒業。2003年 山口大学大学院医学研究科修了。2010年同大学医学部附属病院先進救急医療センター助教。2011年より現職。
- 【関連コンテンツ】
