メドメイン,【病理AIの開発に成功】「乳腺非浸潤性乳管癌」を病理組織デジタル標本から検出可能に~ Springer Nature社が発行する「Virchows Archiv誌」に論文が掲載 ~
2022-2-3
デジタル病理支援ソリューション「PidPort」を提供するメドメイン(株)(以下「メドメイン」)は,Deep Learning(深層学習)を用いることで,乳腺の病理組織デジタル標本において,非浸潤性乳管癌を浸潤性乳管癌と識別する人工知能の開発に成功した。
また,この開発に関する論文をSpringer Nature社が発行するVirchows Archivに投稿し,2022年1月25日に掲載された。(掲載箇所:https://link.springer.com/article/10.1007/s00428-021-03241-z
)
■本研究成果の概要
乳腺病理組織デジタル標本において,非浸潤性乳管癌を浸潤性乳管癌と識別する人工知能の開発に成功した。
■本研究の背景
本研究は,2021年10月にCancers誌に発表した乳腺浸潤性乳管癌を検出する人工知能の開発(https://www.mdpi.com/2072-6694/13/21/5368
)に引き続く一連の乳腺病理AI開発。従前,弊社より論文発表してきた「弱教師あり学習(weakly-supervised learning)」および「回帰型ニューラルネットワーク(RNN)」に関する研究を応用し,開発した。(代表論文:https://www.nature.com/articles/s41598-020-58467-9
/ https://www.nature.com/articles/s41598-021-87644-7
)
非浸潤性乳管癌は,乳癌検診におけるマンモグラフィの導入などにより,全乳癌のうち10%程度にまで増加している。非浸潤性乳管癌は,癌巣を完全に切除すれば予後良好で,実際の臨床で問題となるのは,「浸潤巣の見逃しのない非浸潤性乳管癌」になる。
今回の研究の目的は,乳腺病理組織デジタル標本(生検・手術材料)において,非浸潤性乳管癌と浸潤性乳管癌との識別を可能にする人工知能を深層学習を用いることで開発することにある。
■本研究の内容
本研究では国内の医療機関(国際医療福祉大学三田病院,JA北海道厚生連札幌厚生病院)から,乳腺病理組織標本(生検および手術材料)の提供を受け,「少数例の病理医によるアノテーションデータ」ならびに「弱教師あり学習に回帰型ニューラルネットワークを併用した」深層学習を行うことで,精密かつ大量のアノテーションデータを用いることなく,乳腺非浸潤性乳管癌を識別する人工知能を開発した。また,開発した人工知能については,教師データとは異なる検証症例を用いて精度の検証を行った。
■本研究の成果
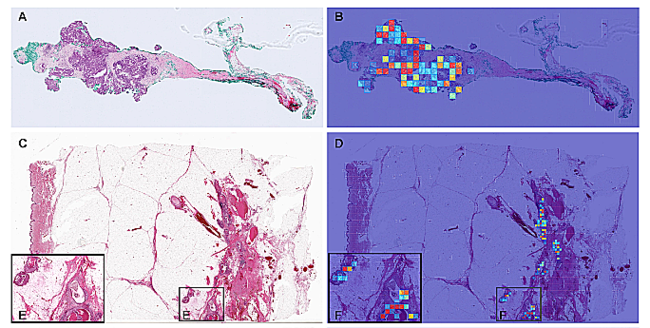
開発したモデルを検証したところ,検証症例において,ROC-AUCが非浸潤性乳管癌において0.960,浸潤性乳管癌において0.977という極めて高い精度の結果が得られた。また,ヒートマップにより表示された人工知能が識別した乳腺非浸潤性乳管癌および浸潤性乳管癌を示唆する領域は,病理医による検証の結果,妥当であることが確認された。
本研究成果のポイントは,境界病変あるいは曖昧さを含むような病変においても,精度の担保された人工知能の開発が可能であり,病理医による大量の詳細なアノテーションデータは必ずしも必要であるとは限らないことを示唆している点である。すなわち,「不完全な情報」に基づく推論が可能であることを意味している。
今回開発した人工知能モデルの検証を,さらに複数施設並びに大規模症例にて行い,検証を進めていく。
■ 共同研究者のコメント ~ 本研究の意義と今後の展望について ~
札幌厚生病院 病理診断科 主任部長
市原 真
乳腺の手術検体や生検検体において「癌」を発見し,浸潤の有無(癌が乳管外に浸みだしているか否か)を弁別することは,しばしば熟達した病理医をも悩ませます。この作業は極めて専門的ですが,わかりやすく例えるならば,「リンゴの木がいっぱい生えた果樹園で,リンゴではなくナシが紛れていることを見極めること」や,「リンゴに混じっているナシの実のうち,熟しているものだけを見抜くこと」に似ています。都会の路地裏にナシの実が落ちていれば誰でも気づくことができるでしょう。しかし,ナシがリンゴに紛れていれば難しさは上がりますし,リンゴが青リンゴばかりであればより丁寧に見極めないとナシを見落としてしまいます。まして,その中に潜んだ「熟しすぎてこれから悪くなるであろうナシ」を探し当てるのは難しいのではないでしょうか。
乳腺の病理診断が難しい理由のひとつは,「癌と見間違えがちな良性病変」が多数存在することにあります。たとえば,硬化性腺症sclerosing adenosisと浸潤性乳管癌はよく似た像を呈することがあります。また,radial sclerosing lesionと呼ばれる病変に上皮異型を伴ったものも癌と見間違われやすいです。他にも,病理医は癌と癌でないものを見分ける際に細胞の「核」を見て診断をしますが,アポクリン化生と呼ばれる細胞変化がある場合には「核異型」の判定が当てにならなくなり,良悪の判断がいっそう難しくなります。病変を正しく診断するためには技術と経験が必要です。
さらに,癌であると診断した後も,今度は「どこかで浸潤をしているか,それともまだ浸潤していない癌なのか」を見極める作業が待っています。なぜこれらを細かく見極めなければいけないかというと,浸潤の有無によって再発のリスクも,あるいは推奨される治療方法も異なるからです。癌は,癌と病理診断するだけではなく,それがどれくらい周囲に影響を及ぼしているかまで判断しなければいけない病気です。
乳癌は他の癌と比べ,「体の比較的表面にあって(深部にないので)早期から異常に気づきやすい」,「検診により比較的早期に発見されるケースが多い」などの理由で,浸潤する前の段階や,浸潤しはじめたばかりの段階で病理診断されやすいという特徴があります。つまり,他の癌に比べてもとりわけ「浸潤の有無」が頻繁に判定される病気です。よく言われることですが,「あることを証明するよりも,ないことを証明する方が難しい」のです。浸潤をどこかに見つけたらその病気は直ちに「浸潤癌」と命名できますが,浸潤がないことを証明するためには,検体すべてをくまなく見て,どこにも浸潤がないと証明しなければいけません。先ほどのたとえ話に戻るならば,「リンゴの木は全てチェックしなければいけない」のです。技術と経験に加えて,手間と時間も必要となります。
このように,様々な困難がある乳癌の診断において,病理医はいろいろ工夫をします。たとえば,病変周囲の情報を加味して,難しい病変部を周囲と比べながらじっくり時間をかけてプレパラートを見たり,免疫組織化学(免疫染色)による評価を加えたりして,手数を増やして診断を行っています。
ところが,本研究では,AIは良悪の判断や浸潤の有無を,極めて短時間で,かつH&E染色のみで(免疫染色を用いることなく),高い識別能で見分けることができました。これは驚くべきことです。リンゴとナシの例えのように,乳癌の診断では「癌と間違えやすい良性の状態」が多いにもかかわらず,癌と非癌とを弁別でき,かつ癌がどこで浸潤しているか(浸潤が疑われる場所)をヒートマップを用いて高精度に予測しました。掲載論文のfig(写真)にも載せましたが,乳腺症という良性の(しかし時に癌と見間違いそうになる)状態が広く観察される乳腺の中で,癌の部分だけを正しく指し示している点には,共同研究者(co-first author)ながら感動を覚えます。しかもこれはいわゆる「チャンピオンデータ」(一番うまくいったところだけを論文に載せるということ)ではなくて,今回の検討ではよく見られる現象でした。現役の病理診断医の目でかなり批判的に検討しても「すごいな」と声が漏れるようなヒートマップを何度も何度も目にしたのです。
本研究は,将来に大きな期待を抱かせるものです。現在,全国各地の特に大きい病院ではデジタルスライドスキャナの導入が進んでいますが,乳腺のプレパラートをスキャンする際にAIが実装されていれば,「浸潤があるかもしれない部位」をスキャン後すぐにヒートマップで指摘してくれます。ヒートマップはいわゆる「低確信度」と「高確信度」を分けて表示してくれます(地域ごとに細かく降水確率が表示される天気予報のようなものです)ので,病理医が診断する前に,
1)明らかに浸潤ばかりしている癌
2)大部分が浸潤していない(乳管内に留まる)癌だが,一部で浸潤が疑われる癌
3)浸潤がない癌
がすでに予測されているということになります。これだけでもものすごいことですが,たとえば「一部で浸潤が疑われる」ものに対して,AIから連動して免疫染色をオーダーするシステムを構築すれば,病理医の手元にプレパラートが届くときには「難しい部分にあらかじめ(病理医がオーダーしそうな)免疫染色が行われている」ということが実現します。「病理医がすべてのプレパラート(リンゴの木)を見て,判断が難しいプレパラート(ある1本の木)にだけ免疫染色をオーダーして後日診断を再開する」という作業が省けますので,工程として1~数日の短縮が期待できます。
プレパラートを見る前にある程度信頼度の高い推定診断が与えられること(研修医や専攻医にあらかじめ標本を見てもらって診断の下書きをしてもらうようなものです),ターン・アラウンド・タイム(TAT)の短縮,さらには見逃しを減らす「ダブルチェック的」な使い方も可能になるでしょう。ヒト病理医の日常業務はどんどん楽になり,その分,診断の難しい病気や臨床医とのディスカッション,病気のメカニズムを解明するための研究などに割く時間を増やすことができます。大企業のCEOが秘書に実務の多くを代行してもらって自らは独創的な,あるいは重い責任を伴う仕事に専心するように,病理医もAIという優秀な秘書によってさらに高度な診断を進めることができるのです。
本研究には他にも注目すべきポイントがあります。研究過程において,本項の筆者を含めた複数名がAIを教育する「教師役」を務めましたが,このとき,AIが画像を判定する「極小のタイル」ごとに良悪や浸潤の有無といったラベルを付けたわけではないというのが非常に重要です。複雑な良性病変の間を三次元的に広がっていく乳癌をタイル(ボクセル)ごとにラベリングしていては,研究に膨大な手間がかかります。しかし,本研究ではweakly-supervisedと呼ばれる「あまり細かくラベリングしないで,ざっくりと教え込む」方法が用いられています。マウスで「だいたいこのあたりが非浸潤癌の範囲だよ」とざっくり印を付ける(アノテーションする)だけでAIは十分学習をしてくれたので,これまでの研究におけるアノテーションの細やかさを知る身としては隔世の感がありました。さらに,教師データの数(AIに癌や良性病変を学習させた枚数)も,従来の研究に比べると決して多くありません。それにもかかわらず,これほど高精度の判別が可能になったことは,AI病理診断の研究におけるとても明るいニュースだと思われます。「稀な病気であろうとも,学習する素材が少なかろうとも,AIは人の診断に肉薄して病理医を楽にできるかもしれない」という期待が膨らむからです。
さらに,ここまで読んでくださった方へのお礼としてさらに細部の話をしますと,本研究におけるAIの診断精度は,癌だけではなく「多彩な良性病変」を学習させることでかなり向上しました。このことは,今後のAI病理診断を発展させる上でのよい参考になったと思います。今後は乳腺だけに留まらず,たとえば多彩な良性病変を有する胃(特にピロリ菌感染下での胃粘膜変化にバリエーションが豊富),肝臓(ウイルス性肝炎やNASH/NAFLDによる変化が多彩),卵巣(良性病変のパターンが多い)などにおいても,癌だけではなく良性病変もきちんと学習させることで優れたAIが開発できるかもしれません。
まだまだ書きたいことはあるのですが最後にひとつだけ,論文には書ききれなかったニュアンスの話を書いておきます。本研究においては,AIが「浸潤性乳管癌」と「非浸潤性の癌」との区別を失敗した症例も(少数ですが)あります。しかし,そのような「誤診例」を詳しく解析してみると,じつは,ヒートマップ表示では浸潤と非浸潤の両方を予測している,言ってみればAI自体が「五分五分」と判断していることがあるのです。研究の結果をわかりやすく提示して論文化するためには「五分五分ではなくどちらかに決めなさい!」とAIに指示しますので,こういう症例の一部は誤診に分類されますが,これはある意味,人間の病理医が診断を迷うときとプロセスとして良く似ています。「浸潤か否か!」と二択で答えさせるから間違うのであって,ヒートマップで両方表示させておけば実用に耐えるのではないか,という感想を持ちました。プレスリリースに研究者の感動と感想を書き連ねることの是非は保留させていただくとしても,本研究を元にAI病理診断の世界が確実に次のステージに進むだろうし,そこには人間の病理医と同じようにAIもまた葛藤しながら診断する未来があるのだな,と研究者が感じたことは記録に残しておきたいと思うのです。
■原著論文
▼論文タイトル:A deep learning model for breast ductal carcinoma in situ classification in whole slide images
▼日本語訳:病理組織デジタル標本における「乳腺非浸潤性乳管癌」の識別を可能にする深層学習を用いた人工知能の開発
▼DOI: https://pubmed.ncbi.nlm.nih.gov/35076741/
■著者・所属
<札幌厚生病院 病理診断科 主任部長>
市原 真
<メドメイン(株)>
常木 雅之,Fahdi Kanavati
●問い合わせ先
メドメイン(株)
https://medmain.com/
