国立がん研究センターとAMED,リキッドバイオプシーによる大腸がん術後の再発リスク評価とモニタリングの臨床試験を開始
2020-6-12

オンラインで同時配信された記者発表会
国立研究開発法人国立がん研究センターと国立研究開発法人日本医療研究開発機構(AMED)は2020年6月10日(水),血液を用いたリキッドバイオプシーによるがん個別化医療の実現をめざす新プロジェクト「CIRCULATE-Japan」の開始を発表し,同日,国立がん研究センター築地キャンパス(東京都中央区)にて記者発表会を開催した(オンラインでも同時配信)。記者発表会では,国立がん研究センター理事長の中釜 斉氏による挨拶に続き,国立がん研究センター東病院病院長の大津 敦氏ががんゲノム医療構築に向けた同院の取り組みについて,また,同東病院消化管内科科長の吉野孝之氏がCIRCULATE-Japan設立の経緯と概要,同消化管内科医長で臨床試験の支援部門であるトランスレーショナルリサーチ支援室室長の谷口浩也氏がCIRCULATE-Japanで実施する臨床試験(GALAXY試験,VEGA試験)について解説した。

中釜 斉 氏 |

大津 敦 氏 |
|

吉野孝之 氏 |

谷口浩也 氏 |
国立がん研究センター東病院では,2012年より組織遺伝子診断パネルに基づいた個別化治療の研究に取り組んできた。2015年に設立したがんゲノムスクリーニングプロジェクト「SCRUM-Japan」には,肺がん・消化器がんの患者1万例以上が参加し,産学連携での研究開発により,すでに8剤の新薬,9剤の体外診断薬の薬機法承認を取得するなど,大きな成果を挙げている。リキッドバイオプシー〔血中循環腫瘍由来DNA(ctDNA)を用いたゲノム解析〕については,2018年2月よりステージ4の消化器がんを対象にした「GOZILA study」(n=2863),2019年7月からステージ4の固形がん(肺がんを除く)を対象にした「MONSTAR-SCREEN」(n=486)を開始しており,世界最大規模となる3300例以上の固形がんのリキッドバイオプシーを実施している。
これまでのリキッドバイオプシーの取り組みでは,ステージ4の固形がん(見えるがん)を対象としてきたが,今回設立されたCIRCULATE-Japanでは,根治的外科治療を行う大腸がん(結腸・直腸がん)患者を対象とし,切除後の術後微小残存病変(見えないがん)をターゲットとした臨床試験が行われる(今後,ほかのがん種に拡大予定)。
現在の標準治療では,大腸がん切除後の再発を防ぐため,病理組織検査による術後ステージに基づいて,一律に術後補助化学療法(抗がん剤治療)が行われている。しかし実際には,術後補助化学療法が無益な患者も多く,不要な治療による副作用や後遺症(末梢神経障害など)という不利益が生じていることが課題となっている。そこでCIRCULATE-Japanでは,リキッドバイオプシーにより“見えないがん”をスクリーニングすることで,再発リスクを層別化してより適切な個別化医療の実現をめざすとともに,定期的なモニタリングに用いて再発の早期発見における有用性を検証していく。なお,ctDNA陽性/陰性よる再発予測能は,既知の再発予測マーカーのオッズ比が2以下であるのに対して,16.5と非常に高いと報告されている(Tarazona, N., et al., Abst#4009, ASCO, 2020.)。
CIRCULATE-Japanでは,切除した腫瘍組織を用いて全エクソーム解析を行い,患者ごとのリキッドバイオプシー遺伝子パネルを作成し,これを用いて超高感度にctDNAを検出する検査(Signatera検査:米国Natera社開発)を利用して2つの臨床試験を実施する。一つは,切除可能な大腸がんを対象としたスクリーニング研究(GALAXY試験)で,ステージ2〜4の患者約2500名を対象に術後2年間,定期的にSignatera検査による再発モニタリングを行う。CT検査などによる通常の再発モニタリングも同時に行い,再発の早期発見におけるSignatera検査の有用性を検証する。また,将来活用を見据えて臨床・ゲノム統合レジストリとバンキングを行い,大規模データベースを構築していく。
もう一つのVEGA試験では,術後1か月時点のSignatera検査が陰性のステージ2,3の患者1240名を対象とし,従来の標準治療である術後補助化学療法を行う群と手術単独(術後補助化学療法なし)の群を比較するランダム化第Ⅲ相比較試験を行う。試験の結果,両群の再発率に差がなければ,Signatera検査陰性の患者は術後補助化学療法を省略できると期待される。なお,同試験については世界10か国以上の参加が計画されており,1万5000例の登録を目標に第Ⅲ相試験を実施し,前向き統合解析を行っていく。
CIRCULATE-Japanは,146施設(国内145施設,台湾1施設)が参加する(2020年6月2日現在)。国内外の複数の民間企業が参画し,AMEDの革新的がん医療実用化研究事業の研究開発費を活用した産学共同研究であり,見えないがんを対象とした世界最大規模の医師主導国際共同臨床試験となる。実施期間は2020年4月1日〜2030年3月31日を予定している。
リキッドバイオプシーを用いた再発リスクの層別化や,従来のモニタリング手法よりも早期の再発発見が可能なことが証明されれば,より精密な個別化医療の実現や,不要な薬剤・検査の省略による医療経済効果,患者への負担が少ないモニタリングが可能になる。大腸がん術後補助化学療法の新しい国際的標準治療法の確立にもつながりうるプロジェクトであり,がん治療全体のパラダイムシフトを日本が世界をリードして実現することが期待される。
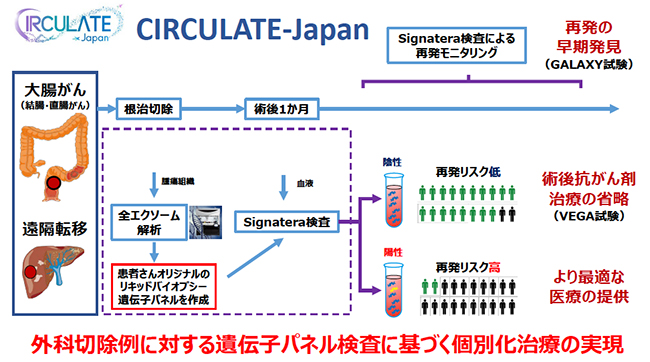
CIRCULATE-Japanプロジェクトの概要
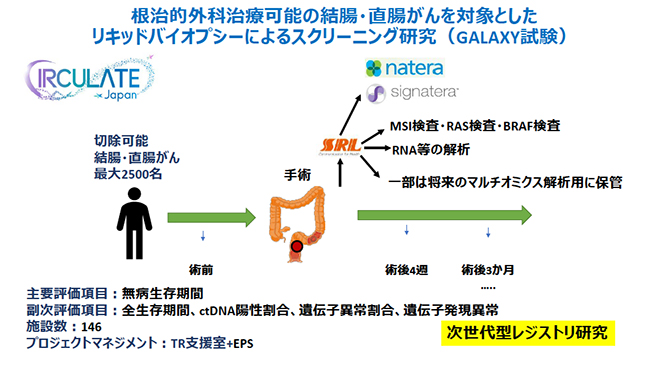
GALAXY試験の概要
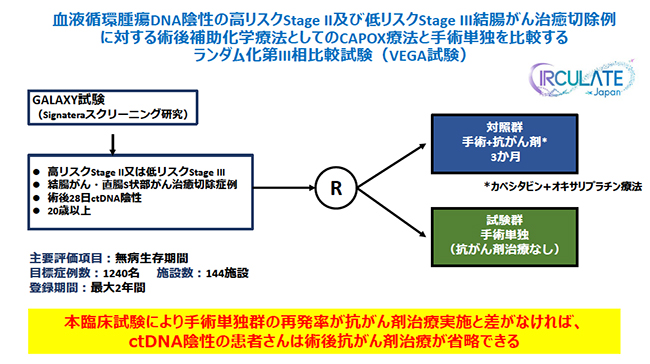
VEGA試験の概要
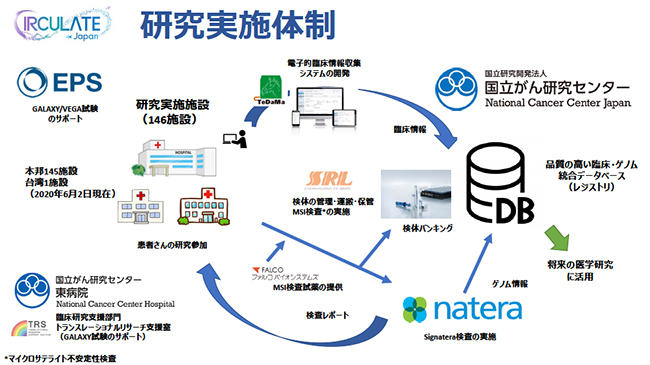
CIRCULATE-Japanの研究実施体制
●問い合わせ先
◆患者・医療関係者・企業からの問い合わせ
国立研究開発法人国立がん研究センター東病院
臨床研究支援部門トランスレーショナルリサーチ支援室担当:束岡広樹
Eメール:circulate_support@east.ncc.go.jp
