セミナーレポート(富士フイルム)
2019年4月11日(木)〜14日(日)にパシフィコ横浜(神奈川県横浜市)で開催された第78回日本医学放射線学会総会において,富士フイルムメディカル株式会社共催のランチョンセミナー8「AI技術(ディープラーニング)を用いた画像診断支援〜実用化に向けた臨床応用と評価〜」が行われた。富山憲幸氏(大阪大学大学院医学研究科放射線統合医学講座放射線医学)を座長に,片瀨七朗氏(杏林大学医学部放射線医学教室)と岩野信吾氏(名古屋大学大学院医学系研究科量子医学)が講演を行った。
2019年7月号
第78回日本医学放射線学会総会ランチョンセミナー8 AI技術(ディープラーニング)を用いた画像診断支援 〜実用化に向けた臨床応用と評価〜
Deep Learning技術を用いた肺結節CADeの有用性評価
片瀨 七朗(杏林大学医学部放射線医学教室)

杏林大学医学部付属病院と富士フイルムは,深層学習(deep learning)を用いた胸部CTにおける肺結節CADe(コンピュータ支援検出)の共同研究を行っている。本講演では,CADの臨床応用の変遷を紹介した上で,共同研究の結果と,今後の日常臨床におけるCADの使用について述べる。
CADの臨床応用の変遷
CAD(コンピュータ支援画像診断)は,CADe(コンピュータ支援検出:computer-aided detection)とCADx(コンピュータ支援診断:computer-aided diagnosis)の2つに分けられる。CADeは,解析結果に基づいて病変候補の位置の情報をマーカーなどで示す機能を持つ。CADxは,CADeの機能に加え,質的診断に関する情報も提示する機能を有する。
商用CADとしては,1998年に検診用マンモグラフィCADeが初めてFDA認可され,2000年に日本でも薬事承認を取得した。2001年には胸部X線画像からの肺がんCADeがFDA認可され,2008年には富士フイルムが国内メーカー初のマンモグラフィCADeとして「FCRデジタルマンモグラフィCAD」を発売した。その後,CTからの肺がんCADe,大腸ポリープCADeなども米国で商用化されている。
CADe開発の共同研究で用いたdeep learningは,AI技術における機械学習の一つである。機械学習は,人間が特徴を定義した上で学習データから特徴量を抽出し,学習,推論する。これに対してdeep learningは,学習データから特徴量を自ら抽出・学習し,推論する技術である。画像認識タスクには,畳み込みニューラルネットワーク(convolutional neural network:CNN)が用いられる。2012年の画像認識コンテスト(ILSVRC)で注目され,改良が進められた結果,現在では画像認識においては人間の能力を超えるまでになっている。医療分野においては,CT画像からの臓器抽出やノイズ低減処理,病変検出などに応用されており,deep learningの導入により大幅な性能向上が確認されている。
肺結節CADeのプロトタイプ開発と評価
今回の共同研究では,検出ターゲットの定義を行い,検出アルゴリズムを開発,当院の臨床データで学習データを作成して性能評価を行った。
1.目的と方法
共同研究の目的は,deep learningを用いた胸部CTにおける肺結節CADeのプロトタイプ開発と,その性能評価,臨床有用性の評価である。特に,臨床的に拾う意義の高い結節の見落としが減るかをポイントに評価した。
学習データは,当院PACSに保存されている胸部CT画像1500例以上で,内訳は正常例,肺炎,間質性肺炎,気管支拡張症,肺がんである。術後症例,放射線治療後,化学療法後の症例は除外した。アルゴリズムは,3D convolutional neural networkを用いている。
2.プロトタイプの概要
肺結節CADeのプロトタイプは,対象データを開いた時点で,すでに肺結節の検出は完了しており,結果を表示する前に全画像の確認を促すアラートが表示される。検出結果を表示すると,スライス位置を示すインジケーターにも結節が検出された位置が示され,各スライスに直接飛ぶことができる。検出された肺結節は,画像上で縁取りされ,計測結果も表示される(図1)。また,画面内に別ビューアを立ち上げてMPR画像で結節を詳細に確認することができる(図2)。読影者はこれらの情報を参照し,各結節についてフォロー対象とするかを判断することになる。
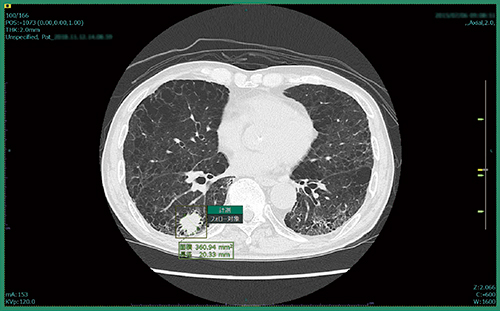
図1 肺結節CADeプロトタイプの結果表示
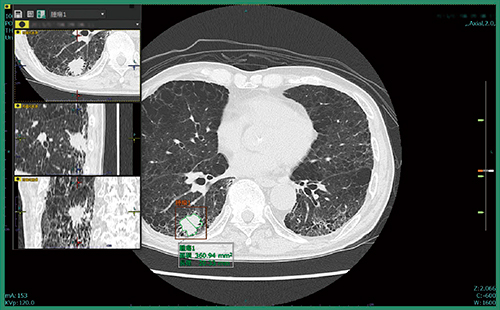
図2 別ビューア(左)でMPR画像を確認
3.読影実験の方法
読影実験では,学習データに使用していない30症例を用いて検出能の評価を行った。結節は孤立性の類円形陰影(solid/part-solidは>3mm,GGNは>5mm)と定義した。2名の放射線診断専門医が独立して0〜10の11段階でスコアリングを行い,少なくとも1名がスコア3以上をつけた結節を経過観察が必要な「正解」と定義し,合計74結節(2.5結節/症例)が該当した。
評価者は10名(診断学の研修を修了した初期臨床研修医3名,後期研修医3名,内科医2名,放射線診断専門医2名)で,統計解析にはJAFROCを用いた。
読影実験のワークフローとしては,CADeなし読影とCADeあり読影を症例ごとに行った。評価者が見落としていてCADeで検出された結節については,CADeあり読影の段階でFollow-upスコアを記録した。
4.読影実験の結果と考察
読影実験の結果,CADe単体の検出率は89.2%(66/74結節),未検出数は0.27個/症例,結節以外の誤検出数は0.73個/症例であった。また,統計解析の結果,評価者全員の平均FOM(figure of merit)は,CADeあり読影で有意に向上した(p=0.0009)(図3)。図4は,評価者は指摘せず,CADeが指摘した症例である。非常に淡いすりガラス状陰影であるが,背景肺に問題がなければCADeでの検出が可能である。また,図5は,評価者もCADeも指摘しなかった症例で,ごく淡い結節は検出が難しかった。
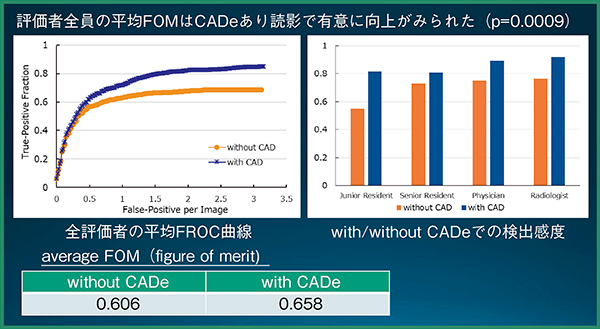
図3 読影実験の統計解析結果
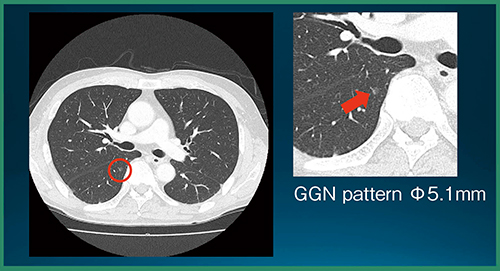
図4 CADeのみで指摘された症例
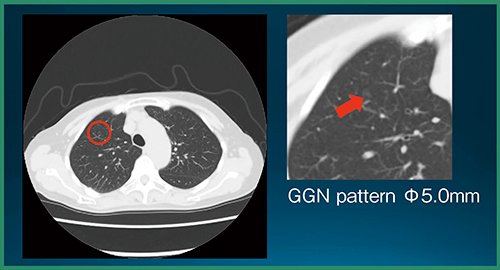
図5 評価者もCADeも指摘しなかった症例
実験から,本CADeがセカンドリーダーツールとして有用であることが示された。放射線科専門医・非専門医問わず,CADeにより検出感度が向上していることから,見落とし防止ツールとして活用できると予測される。
CADeの偽陰性については,学習データにあまり含まれていないパターンの結節であったり,背景肺に気腫性変化やすりガラス状陰影があると,検出が難しくなる。これに対しては現在,アルゴリズムの改良や学習データ増強に努めている。また,CADeの偽陽性については,術後症例で試みると手術痕を検出するなど,非結節構造を誤検出することもあった。読影医であれば誤検出であると直ちに判断できるため臨床上の影響は少ないが,CADe結果確認の負荷を軽減するために改良する必要がある。
日常臨床におけるCADの使用
現在のところCADには,誰が・どこで・どう使うかや,法的規制といった,解決すべき課題が多くある。また,日常診療においては,CADの結果をどのタイミングで確認するかという運用上の問題もあり,今後の法整備によって運用パターンの検討も必要になる。
一方で,CADの応用が進まない原因も複数ある。肺結節や脳動脈瘤など1つのタスクにしか対応していない,開発のためのデータが少ない,偽陽性が多い,結果に対しての理由が明示されない,導入しても診療報酬上のインセンティブがない,といった問題がある。これらの問題を,根本的に短期間で解決することは難しいが,使わなければ進歩もないため,まずは可能な範囲で応用していくことが必要と考える。
また,臨床で使ってもらうためには,使いやすさが重要である。ポイントとしては,(1) 既存PACSに組み込むなどシステムに導入しやすい,(2) 低い導入コスト・ランニングコスト,(3) 読影報告書に反映できる,(4) 研究データとして活用できる,(5) 蓄積したデータを活用できる,などが挙げられ,メーカーにはこれらを意識したCAD開発を期待したい。
画像診断医を取り巻く環境は厳しくなり,負荷は年々増加している。その中で画像診断医は,日常診療における見落とし防止と,読影業務の負荷軽減にAIを活用できないかと期待しており,AI技術を用いたCADがそのためのツールになりうると考える。
まとめ
今回開発している胸部CTでの肺結節CADeを読影時に併用することで,検出能が向上することが確認できた。今後,CADが臨床現場で有効に活用されることが期待されるが,システムの進化には,われわれ臨床医が使用し,改良していく土壌が必要であることを強調したい。
- 【関連コンテンツ】
