セミナーレポート(富士フイルム)
2019年4月11日(木)〜14日(日)にパシフィコ横浜(神奈川県横浜市)で開催された第78回日本医学放射線学会総会において,富士フイルムメディカル株式会社共催のランチョンセミナー8「AI技術(ディープラーニング)を用いた画像診断支援〜実用化に向けた臨床応用と評価〜」が行われた。富山憲幸氏(大阪大学大学院医学研究科放射線統合医学講座放射線医学)を座長に,片瀨七朗氏(杏林大学医学部放射線医学教室)と岩野信吾氏(名古屋大学大学院医学系研究科量子医学)が講演を行った。
2019年7月号
第78回日本医学放射線学会総会ランチョンセミナー8 AI技術(ディープラーニング)を用いた画像診断支援 〜実用化に向けた臨床応用と評価〜
骨転移診断における3次元CT経時差分技術の臨床応用
岩野 信吾(名古屋大学大学院医学系研究科量子医学)

われわれと富士フイルムは十年来,特に胸部CTに役立つCADの共同研究を行ってきた。本講演では,骨転移診断における3D-CTを用いた経時差分技術について報告する。
研究の背景
原発性肺がんの治療中・治療後の患者には,骨転移がしばしば合併する1)。最も転移を生じやすい部位は脊椎2)であるが,脊椎転移は疼痛を生じるだけでなく,圧迫骨折や神経障害を引き起こし,患者のQOLを著しく悪化させる。患者のQOLを守るためには,症状が出る前の早期発見・早期治療が必要である。
肺がん患者に対しては,治療が開始されると再発や転移の検索,治療効果判定のために胸部CTが定期的に撮影される1)。CTによる骨転移検出はMRIやPETに劣るとされているが2)〜4),肺がん治療中に定期的にPETや脊椎MRIを撮像することは現実的でなく,疼痛など骨転移を疑う症状が生じた時に精査しているのが現状である。そして,そのような症例について以前のCTを見直すと,微小な脊椎転移が描出されていることがある。
胸部単純X線画像の現在画像から過去画像をコンピュータ上で引き算する経時差分法は,すでに商用化されている5),6)。われわれは,それを応用して,非剛体位置合わせによる3D-CT画像の経時差分を行うことで溶骨性・造骨性の肺がん骨転移病変の候補を検出できる可能性があると考え,ソフトウエアを用いた検討結果を2017年に報告した7)。
3D-CTの経時差分技術による肺がん骨転移病変候補の検出7)
このソフトウエアでは,PACSから読み込んだCTの過去画像と今回画像の各椎骨を分離・同定し,非剛体位置合わせの上,差分を行う。その結果をカラー画像にして,今回画像に重ねて表示する。不透明度が上がった部分は寒色系,不透明度が下がった部分は暖色系で表現される。ある程度の大きさの骨転移病変ならば差分画像がなくても診断は容易だが,図1のような小さな病変(左横突起への骨転移)は,疼痛がない場合は経過観察で見逃してしまう可能性があり,ソフトウエアを用いた差分画像が役立つと言える。
その可能性を確認するため,読影実験を行った。対象は,肺がんの経過観察中に脊椎転移を生じた15症例と,生じなかった15症例で,395椎骨(C6〜L3)のうち46か所に骨転移が見られた。病変の内訳は,溶骨性(n=17),造骨性(n=14),混合型(n=6),病的骨折(n=9)で,部位は36か所が前方成分,10か所が後方成分である。2.5年の胸部CT読影経験を有する2名の放射線科レジデントが,それぞれ30症例の初回と経過観察の画像を通常通り読影後にソフトウエアを用いて読影し,ソフトウエアにより拾い上げがどれだけ増えるかを検討した。
その結果,いずれの読影者もソフトウエアを用いることで感度が向上(0.717→0.826,0.783→0.848)した。ROC解析では両者ともAUCが上昇し,1名は有意差をもって診断能が向上した(0.849→0.902,p=0.021)。また,病変ごとに見ると,溶骨性,造骨性のいずれもソフトウエアを用いることで多く検出でき,骨転移のタイプによる差はあまりなかった。部位については,後方成分の棘突起,横突起,椎弓の骨転移はソフトウエアを使用した方が多く検出できた。
この検討では,単純な非剛体位置合わせを用いたソフトウエアを使用したが,問題点があることもわかった。1つは,病的骨折(圧迫骨折)を生じて大きく変形した椎骨は位置合わせが困難であること,もう1つは脊椎番号がわかりにくいことである。骨転移の有無はソフトウエアを用いることで短時間に判断できるが,椎骨番号の判断に時間がかかり,読影に1症例あたり約3分半を要した。
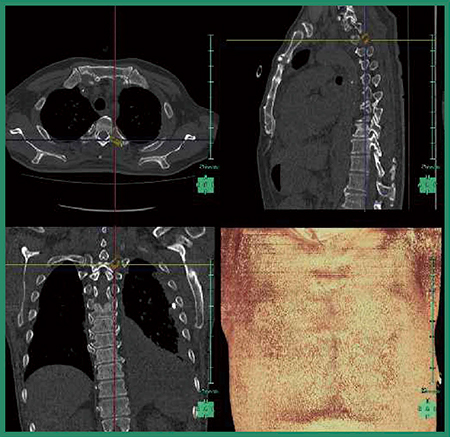
図1 従来版ソフトウエアによる左横突起への骨転移候補の検出
AI技術活用による改善
上記検討で判明した問題点を改善するため,AI技術をソフトウエア設計に用いた2つの機能を実装した。1つは骨ラベリング機能で,これにより椎骨番号が自動で認識・表示される。病的骨折で変形,あるいは上下が融合しているような椎骨についても,分離・ラベリングが可能となった。もう1つは位置合わせ機能で,これにより従来版と比べて差分計算が5〜10倍に高速化した。また,汎用性も向上し,肋骨や骨盤なども位置合わせができるようになり,脊椎以外への骨転移の診断にも応用可能である。
症例1は,肺がん術後症例で肺の形が変形しており,撮影範囲も過去画像は胸部のみ,今回画像は胸腹部と大きく異なっていた。改良版ソフトウエアで差分を取ると,溶骨性の骨転移が青く表示され,椎骨が変形している様子もわかる(図2)。また,自動でラベリングされるため,椎骨番号の判断が容易となり,T4,T5であると判断できる(図3)。さらに,T1にも溶骨性の小さな骨転移があることが明瞭にわかる(図4)。
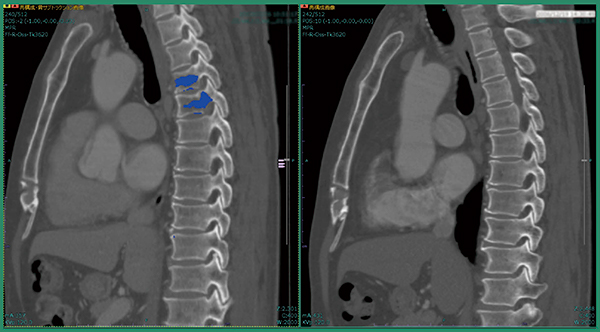
図2 症例1:改良版ソフトウエアによる骨転移候補の検出
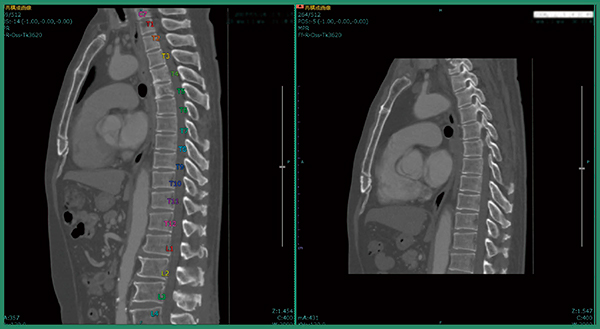
図3 症例1:椎骨番号の自動ラベリング
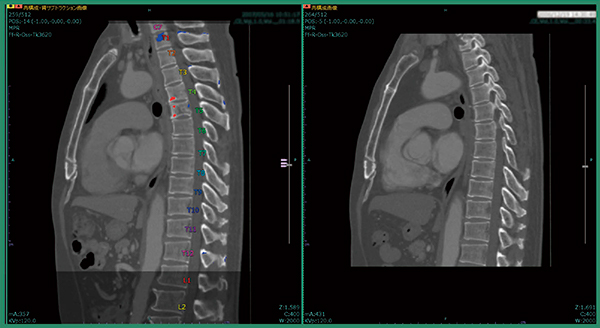
図4 症例1:T1の微小な骨転移候補の検出
症例2も術後症例で,術前・術後の差分画像にてT10に骨転移が認められた。これは元画像でも比較的わかりやすいが,本症例はC7の椎弓にも造骨性の骨転移があることが差分画像で明瞭に示された(図5)。このような後方成分の小さな病変に対しては,ソフトウエアが特に役立つと考える。
共同研究で開発したソフトウエアは,読影端末上で操作が可能である。CT画像がPACSから読影端末に配信された時点で,過去画像をPACS内で自動検索して経時差分処理をバックグラウンドで行い,読影開始時には差分結果を即座に表示できるようなストレスのないシステムをめざしていきたい。
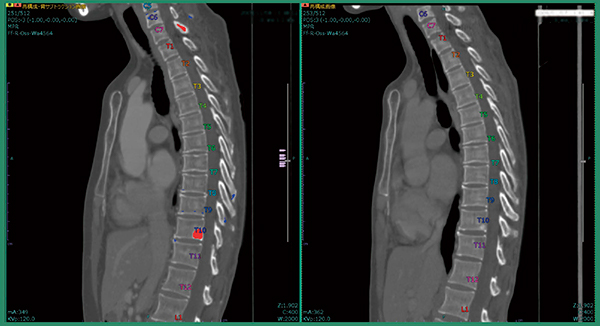
図5 症例2:T10とC7椎弓への骨転移候補の検出
造影CTに経時差分を応用した骨転移候補の検出
経時差分は骨転移候補の検出に有用であるが,過去画像がなければ経時差分画像を作成できないという問題点がある。これに対する解決策の一つとして,単純CTと造影CTで差分を取ることを試みた。経時差分と言っても,必ずしも別の日のCT画像である必要はなく,同日の単純画像と造影画像の時間差でも,経時差分画像が作れるのではないかと考えた。
症例3は,肺がん術前の症例である。単純CTと造影CTで差分を取ると,T11に造骨性の骨転移があることが確認できた(図6 b→)。また,詳細に観察するとT7にもわずかに造影効果があり,差分画像で青く表示された(図6 a)。PET/CT検査では,差分画像でカラー表示された部位に一致してFDG集積が認められ(図6 c→),同日の単純画像と造影画像の差分検出に本ソフトウエアが活用できる可能性が示された。
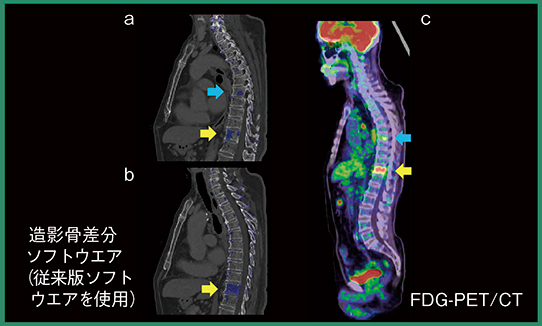
図6 症例3:造影CTの差分画像による骨転移候補の検出
まとめ
AI技術を設計に利用した3次元CT経時差分技術は,がん患者の経過観察CTにおける骨転移の診断を補助することができると考える。
*記事中のソフトウエアはすべてプロトタイプ
●参考文献
1)日本肺癌学会:肺癌診療ガイドライン. 2015.
2)日本臨床腫瘍学会:骨転移診療ガイドライン. 2015.
3)Takenaka, D., et al.:Detection of bone metastases in non-small cell lung cancer patients;Comparison of whole-body diffusion-weighted imaging(DWI), whole-body MR imaging without and with DWI, whole-body FDG-PET/CT, and bone scintigraphy. J. Magn. Reson. Imaging, 30・2, 298〜308, 2009.
4)Qu, X., et al.:A meta-analysis of 18FDG-PET-CT, 18FDG-PET, MRI and bone scintigraphy for diagnosis of bone metastases in patients with lung cancer. Eur. J. Radiol., 81・5, 1007〜1015, 2012.
5)Sakai, S., et al.:Integration of temporal subtraction and nodule detection system for digital chest radiographs into picture archiving and communication system(PACS);Four-year experience. J. Digit. Imaging, 21・1, 91〜98, 2008.
6)Sasaki, Y., et al:Clinical usefulness of temporal subtraction method in screening digital chest radiography with a mobile computed radiography system. Radiol. Phys. Technol., 4・1, 84〜90, 2011.
7)Iwano, S., et al.:Thoracic Temporal Subtraction Three Dimensional Computed Tomography(3D-CT);Screening for Vertebral Metastases of Primary Lung Cancers. PLOS ONE. 12・1, e0170309, 2017.
- 【関連コンテンツ】
