GE Healthcare Japan Edison Seminar 2019
2019年12月号
GE Healthcare Japan Edison Seminar 2019
【核医学】Theranosticsを軸とした画像診断の将来展望
中本 裕士(京都大学大学院医学研究科放射線医学講座)

画像診断の進歩は著しく,核医学においては,PET/CTやSPECT/CT,PET/MRIの登場により,形態と代謝の両方の情報を容易に評価可能となった。なかでも腫瘍の画像診断においては,形態および代謝情報の融合画像による病変の発見と評価が期待されている。さらに,近年では,診断と治療を融合した“Theranostics”が注目されている。本講演では,核医学の進歩について,融合画像の有用性とTheranosticsを中心に報告する。
融合画像の有用性
1.病変の発見における有用性
いわずもがなであるが,FDG-PET/CT検査は効率的な病変の検索が可能であり,しばしば予期せぬ遠隔転移や重複がんの同定に役立つ。また,全身における集積亢進領域の分布パターンから疾患を推測することも可能である。PETのMIP像によって想定されていなかった疾患を推測でき,適切な治療に至った症例を紹介する。
症例1は,30歳代,女性。呼吸器外科より前縦隔腫瘍の転移巣検索が依頼され,PETを撮像したところ,前縦隔の腫瘤のみならず,骨格筋にもびまん性の集積が認められた(図1)。集積パターンから甲状腺機能亢進症を疑ったところ,甲状腺ホルモンの著明な高値,甲状腺刺激ホルモンの低値を認め,甲状線機能亢進症の診断,治療が開始された。予定されていた手術のみならず,生検も回避することができた。
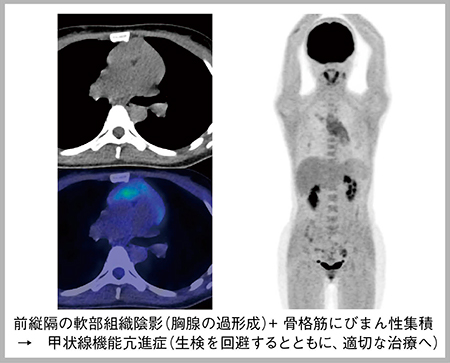
図1 症例1(30歳代,女性):甲状腺機能亢進症
2.病変の評価における有用性
PET検査による病変の評価とは,主に治療効果判定と予後予測であり,初診時や治療後の予後予測,導入化学療法後の治療効果判定と再病期診断などがある。非小細胞肺癌では,原発巣のFDG集積度(SUV)がステージⅠ肺がんの予後予測因子であることや,原発巣に対してSUVが5を超えると,5以下の症例よりも予後が悪いことが報告されている1),2)。
治療効果判定や予後予測が臨床上,重要な意味を持つ疾患に悪性リンパ腫がある。例えば,ホジキンリンパ腫では,標準治療としてABVD療法(抗がん剤4種)を6〜8サイクル実施するが,中間PET(interim PET)による治療効果判定を行った検討のメタ解析の結果,診断精度は比較的良好であった3)。また,ABVD療法を2サイクル終了後にinterim PETで陰性の患者を,ABVD群とAVD群(ブレオマイシンを除外)にランダムに分けて検討したところ,progression-free survival(PFS)に差はなかったが,overall survival(OS)はABVD群の方がやや低かった4)。AVD群ではブレオマイシンの除外により有害事象が軽減されたことがOSの改善につながったと考えられ,治療方針の変更は今後,正当化されると思われる。さらに,interim PETで陽性の患者の治療をより強いレジメン〔ABVD療法→BEACOPP(ABVD増量)療法〕に変更した検討5)では,2年後のPFSが60%であった。変更しなければPFS<30%程度であることを考えると,治療法の変更は良好な結果をもたらすと言える。
“Theranostics”と治療効果の予測
Theranosticsは,therapyとdiagnosticsを融合した造語で,イメージングを利用して診断し,治療の適格性や治療薬の投与量などを評価する手法である。核医学領域では,放射性薬剤(プローブ)を体内に投与して生体内の情報を画像として得るとともに,主に腫瘍に対する治療を行う。薬剤に標識する放射性核種(RI)の量や種類を変えることで,類似化合物による画像診断と内照射治療が可能となる。PubMedでTheranosticsを検索すると,論文数はここ数年で指数関数的に増加しており,世界的なトレンドの一つと言える(図2)。以下に,Theranosticsの最近の代表例を紹介する。
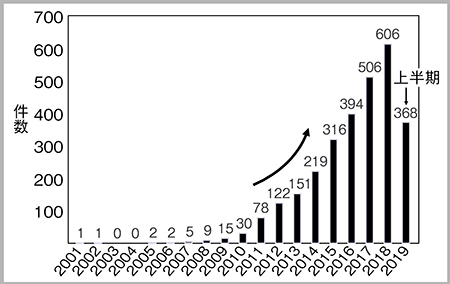
図2 PubMedにて“Theranostics”でヒットした論文数の経時的推移
1.ソマトスタチン受容体イメージングとPRRT
神経内分泌腫瘍(NET)のG1/G2といったソマトスタチン受容体(sstr)が発現する腫瘍は,FDG-PETでは異常集積を認めないことが多いが,ソマトスタチン受容体イメージング(SRI)で明瞭に描出される。このSRIは核医学的画像診断法の一つであり,sstrに親和性を有し,生体内で安定なオクトレオタイドをRIで標識した検査薬を用いる。現在,保険診療としては塩化インジウム(111In)標識の「オクトレオスキャン」(富士フイルム富山化学社販売)を使用でき,SPECTやSPECT/CTを用いて転移巣の描出が可能である。また,ガリウム68(68Ga)標識のオクトレオタイド(68Ga-DOTATOC)を用いたPET/CTでは,肝転移や骨転移がより明瞭に陽性描画される。さらに,オクトレオタイドに標識するRIを,β線を放出するイットリウム90(90Y)やルテチウム177(177Lu),あるいはα線を放出するビスマス213(213Bi)に変更すれば,ペプチド受容体放射性核種療法(peptide receptor radionuclide therapy:PRRT)が可能となる。
症例2は,30歳代,男性,膵神経内分泌腫瘍(pNET)の症例である(図3)。PRRT用の放射性薬剤は薬機法承認が得られておらず,国内で治療できないため,当院にて68Ga-DOTATOC-PET/CTで診断を行い,欧州にてPRRTが施行された。PRRT前の画像(図3 a)では多発肝転移・骨転移およびリンパ節転移が認められるが,PRRTを4回実施後(図3 b)には病変の大幅な減少が認められ,6回実施後(図3 c)にはさらに減少している。
中腸由来のsstr陽性NETに対する177Lu-DOTATATEによるPRRTの効果について,多施設共同ランダム化比較試験の第Ⅲ相試験が欧米で行われ,コントロール群と比較して,PRRT群の方がPFS,OS共に有意に良好であった6)。ほかの臨床試験でも同様の結果が得られており,PRRTは期待できる治療法であると考える。
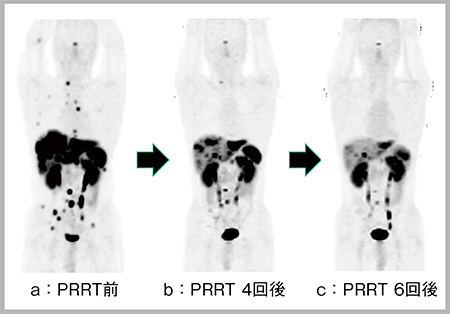
図3 症例2(30歳代,男性):多発転移を伴う膵神経内分泌腫瘍に対するPRRT後の変化
2.前立腺がんに対するPSMA-PETと治療
高リスク・局所進行前立腺がんの遠隔転移の除外目的に行われる画像診断法は,日本では多くの場合,骨シンチグラフィ+CTであるが,ヨーロッパではPETも一般的である。前立腺がん用の次世代のトレーサーの一つであるPSMA-PETは,骨シンチグラフィよりも良好に骨転移を描出できると報告されている7)。また,前立腺がんの治療においては,転移性疾患に177Lu-PSMA-617,難治性疾患にアクチウム225(225Ac)-PSMA-617を用いて劇的に奏効した例が報告されている8)。
3.ケモカイン受容体とイメージング・治療
ケモカイン受容体の19種の機能的受容体のうち,CXCR4の発現を評価可能なPET製剤が68Ga-Pentixaforである。多発性骨髄腫では,タイプによってFDGよりもPentixaforの方が描出能に優れていることから,PentixaforをFDGと相補的に用いることで病変をより確実に同定し,CXCR4の発現を評価して治療につなげることができる9)。さらに,β線とγ線の両方を放出する177LuをPentixatherに標識すれば,治療はもとより,治療後の画像で治療効果判定や予後予測も可能となる。
ケモカイン受容体イメージングでは,T細胞性前リンパ球性白血病や副腎皮質がん,肺がん(小細胞肺癌)なども陽性描画できることが知られており,今後の展開が期待される。
4.64Cu-DOTA-trastuzumab-PETによる HER2の評価
銅64(64Cu)-DOTA-trastuzumabを投与して48時間後に撮像することで,HER2レセプターの発現状態を非侵襲的に評価することができる。国内では,乳がん原発巣や脳転移病巣の評価に用いた例が報告されている10)。また,より半減期の長いジルコニウム89(89Zr)-trastuzumabを用いてPETにて脳転移の検索を行ったところ,5日後の画像が最も明瞭に病変を描出できたとの報告もある11)。乳がんの場合,腫瘍内不均一性(腫瘍内のがんゲノムの多様性)はもとより,多発転移における腫瘍間の不均一性もあることから,このような画像診断が,今後ハーセプチンなどの比較的高価な薬剤を投与する前に一定のニーズを持つ可能性がある。
5.治療効果予測におけるその他の活用法
免疫チェックポイント阻害剤など高額な薬剤では,画像診断による治療効果予測が期待されている。preliminary studyではあるが,20人を対象に免疫チェックポイント阻害剤を投与後3〜4週間目にFDG-PET/CT撮像を行いRECISTによる評価基準でSDと判定されたものに対し,FDGの集積程度の減少率を加味して評価したところ,ベネフィットの有無を95%の精度で区別できたとの報告がある12)。治療薬が有効な群を画像診断で抽出できれば,有害事象の低減やコストの削減につながる可能性がある。
まとめ
腫瘍に対する画像診断では,形態と代謝の情報を利用することが,効率的な病変検索に有用と考えられる。また,核医学領域の進歩は,診断のみならず,より適切な治療(個別化治療)につながる可能性があり,今後いっそうの発展が期待される。
●参考文献
1)Higashi, K., et al., J. Nucl. Med., 43・1, 39〜45, 2002.
2)Berghmans, T., et al., J. Thorac. Oncol., 3・1, 6〜12, 2008.
3)Terasawa, T., et al., J. Clin. Oncol., 27・11, 1906〜1914, 2009.
4)Johnson, P., et al., New Engl. J. Med., 374・25, 2419〜2429, 2016.
5)Press, O.W., et al., J. Clin. Oncol., 34・17, 2020〜2027, 2016.
6)Strosberg, J., et al., N. Engl. J. Med., 376・2, 125〜135, 2017.
7)Pyka, T., et al., Eur. J. Nucl. Mol. Imaging, 43・12, 2114〜2121, 2016.
8)Kratochwil, C., et al., J. Nucl. Med., 57・12, 1941〜1944, 2016.
9)Lapa, C., et al., Theranostics, 7・1, 205〜212, 2017.
10)Tamura, K., et al., J. Nucl. Med., 54・11, 1869〜1875, 2013.
11)Dijkers, E.C., et al., Clin. Pharmacol. Ther., 87・5, 586〜592, 2010.
12)Cho, S.Y., et al., J. Nucl. Med., 58・9, 1421〜1428, 2017.
- 【関連コンテンツ】
