セミナーレポート(ザイオソフト)
2019年4月11日(木)〜14日(日)の4日間,パシフィコ横浜で第78回日本医学放射線学会総会が開催された。14日に行われたザイオソフト株式会社/アミン株式会社共催のランチョンセミナー28「Ziostation2のECV解析による組織性状診断の確立」では,粟井和夫氏(広島大学大学院医歯薬保健学研究科放射線診断学研究室教授)が座長を務め,尾田済太郎氏(熊本大学大学院生命科学研究部画像診断解析学講座講師)と福倉良彦氏(鹿児島大学大学院医歯学総合研究科放射線診断治療学分野准教授)が講演した。
2019年8月号
JRC 2019 Ziosoft / Amin Seminar Report Ziostation2のECV解析による組織性状診断の確立
心 臓
尾田済太郎(熊本大学大学院生命科学研究部画像診断解析学講座)
本講演では,「Ziostation2」を用いた心臓の細胞外容積分画(extracellular volume fraction:ECV)解析について,症例を交えて述べる。
心筋線維化の評価
心筋線維化は,心筋障害と密接に関係している。心筋障害が起こると間質に線維化が生じてスペースができ,心筋のECVが増加する。つまり,心筋障害と心筋線維化,ECVの増加はほぼ相関している。従来,心筋線維化を評価するためには,遅延造影(LGE)MRIが施行されてきた。LGEは,高度な線維化やECVの大幅な増加を視覚的に評価できるメリットがある。一方で,LGEの限界およびデメリットは,軽度な線維化やECVの軽微な増加を検出できず,また,びまん性の心筋障害は過小評価となり,さらに,定量的な評価が困難で,高度腎障害患者や透析患者には適応できないことが挙げられる。
T1 mappingの位置づけ
このLGEの限界およびデメリットを補完する手法がT1 mappingである。T1 mappingは,心筋のT1緩和時間を測定して心筋組織性状を定量的に評価でき,その最もスタンダードな撮像法がShortened MOLLI(ShMOLLI)法である。また,T1 mappingには,造影剤を使用しないNative T1と,造影前後のT1値の変化をヘマトクリット値で補正して算出するECVがある。Native T1は,心拍数や装置,シーケンスの影響を受けやすく,施設ごとに正常値を設定する必要がある。一方,ECVは心拍数や装置,シーケンスにかかわらず一定の値を示す。この2つの指標の違いとしては,Native T1は心筋全体(細胞内外)のダメージの定量的な指標であり,ECVは細胞外容積の広がり(線維化や間質拡大)の定量的指標である。また,いずれもLGEよりも検出感度が高く,病変の早期検出が可能である。さらに,両者は心筋障害が強くなると値が上昇し,特に心アミロイドーシスでは高い値となる。一方で,ファブリー病や鉄の蓄積はNative T1が短縮され低い値となる。すでにエビデンスも蓄積されており,SCMRのガイドラインでは,心臓MRIのルーチン検査としてT1 mappingを標準プロトコールに組み込むことを推奨している。
T1 mappingの症例提示
当院でも心臓MRIのルーチン検査において,T1 mappingをLGEの前後に施行している。Native T1とECVの計測については,Ziostation2のアプリケーションである“MR心筋T1マッピング”を使用している。以下,当院におけるT1 mappingが有用だった症例を提示する。
症例1は,57歳,男性で,腎機能障害のために造影MRIを施行できなかった。ejection fraction(EF)は82%で,収縮機能を保持した心不全(HFpEF)であった。そこで,Native T1によるT1 mappingを施行したところ,T1値の高度な延長(マップ上の赤い部分)を認め,心アミロイドーシスが強く疑われた(図1)。骨髄生検・心筋生検の結果,多発性骨髄腫に合併した心アミロイドーシス(AL type)と診断された。
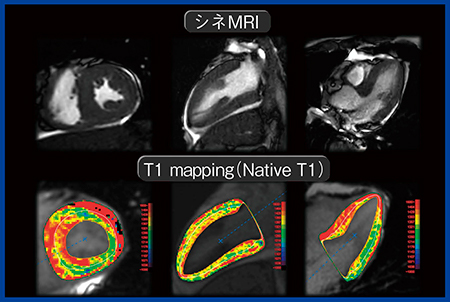
図1 症例1:57歳,男性,多発性骨髄腫に合併した心アミロイドーシス
症例2は,62歳,女性で,心電図異常と心肥大を指摘されたことから,精査目的で心臓MRIを施行した。T1 mappingでは,ECVは異常を認められなかったが,Native T1は,当院の正常値を有意に下回っており,ファブリー病が強く疑われた(図2)。その後遺伝子検査が施行され,ファブリー病と診断された。
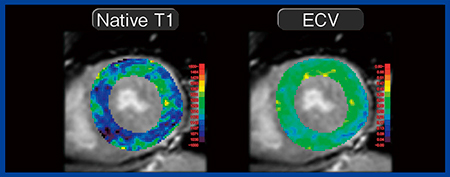
図2 症例2:62歳,女性,ファブリー病
図3は,心肥大およびHFpEFの精査である。症例3,4いずれもシネMRIとLGEでは,特異的な所見は認められなかったが,T1 mappingを施行すると,症例3ではNative T1とECVに軽度の異常が認められ,症例4ではNative T1,ECVがいずれも非常に高い値を示し,症例3は高血圧性心筋症,症例4は心アミロイドーシスと診断された。
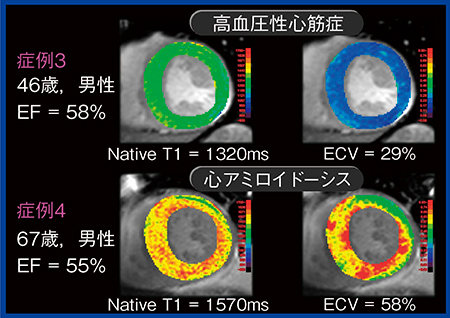
図3 症例3:46歳,男性,高血圧性心筋症,
症例4:67歳,男性,心アミロイドーシス
症例5は,45歳,男性で,白血病の既往があり,心室細動による心肺停止状態で搬送され,救急外来で蘇生したものの不整脈が続いていた。不整脈の精査目的で心臓MRIを施行したところ,シネMRIとLGEでは所見を得られなかったが,T1 mappingでは,Native T1で当院の正常値を下回る値となり,鉄の蓄積が疑われた(図4)。患者は,白血病後の汎血球減少症に対して輸血療法中であり,このことから鉄の蓄積による心ヘモクロマトーシスと診断された。
T1 mappingは,Native T1,ECVいずれも心筋障害を定量的に評価でき,疾患診断,重症度・リスク評価に有用である。また,撮像および画像処理も容易で,clinical decision makingに有益な情報をもたらすことから,標準プロトコールに組み込むことが推奨される。しかし,心臓MRIは複雑な撮像技術や長い撮像時間などの課題がある。
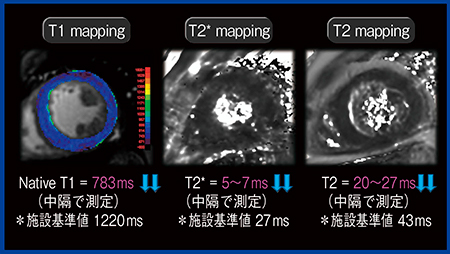
図4 症例5:45歳,男性,鉄の蓄積による心ヘモクロマトーシス
CTの遅延造影とECV
そこで近年,CTによるヨード造影剤による遅延造影(LIE)やECVの評価が行われるようになってきた。LIEは最近の技術開発により,低管電圧撮影と逐次近似画像再構成法を併用することで画質が向上している。さらに,dual energy CTでの仮想単色X線画像の低keVを用いることでLIEのコントラスト分解能も向上し,MRIのLGEと同等の評価が可能になってきた。従来の心臓CTに遅延相を追加するだけでECVを得られることも,実臨床では非常に有用である。
CTでのECV解析には,single energy CTでの心筋造影効果から算出するサブトラクション法と,dual energy CTのヨード密度画像から得られたヨードマップを用いる手法がある。Ziostation2の“CT心筋ECV解析”では,サブトラクション法だけでなく,ヨードマップを用いたECVの解析もwork in progressとして可能である。当院の場合,冠動脈CTAから7分後に遅延相の撮影を追加し,LIEとECVという付加情報を得るようにしている。以下に,LIEとECVが有用だった症例を示す。
症例6は,80歳,女性で,急性胸痛で来院し,心臓CTを施行した。CTAで主幹動脈に有意な所見は得られなかったが,LIEでは側壁に造影剤の染まりを確認でき,ECVでも明らかな異常が認められた。VRとECVのフュージョン画像では,分岐動脈の狭窄の末梢にECVが増加している領域が認められ,急性期心筋梗塞と診断された(図5)。
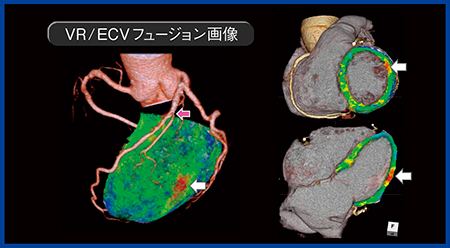
図5 症例6:80歳,女性,急性心筋梗塞
症例7は,67歳,女性で,急性胸痛で来院した。心臓CTでは冠動脈に狭窄は認められず,心尖部壁運動が低下していたが,LIEでは所見はなかった。そこで,ECVを追加したところ,心尖部に高度なECVの上昇域を認め,フュージョン画像で確認した上で,たこつぼ心筋症と診断された(図6)。
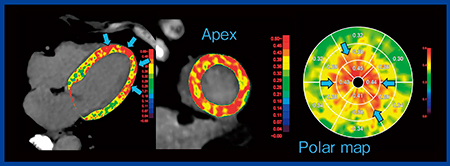
図6 症例7:67歳,女性,たこつぼ心筋症
また,透析患者の場合,心臓MRIのLGE,ECVは適応とならないが,ヨード造影剤を使用する心臓CTでのLIE,ECVは施行可能である。さらに,ペースメーカーを埋め込んだ患者では,心臓MRIは困難であるが,心臓CTは施行できる。このほか,サルコイドーシスでは,CTでリンパ節病変と心病変を同時に評価することが可能である。
このように,心臓CTは,心臓MRIと同等の遅延造影,ECVの評価が可能になりつつあり,将来的には心臓MRIの一部を代替できる可能性を秘めている。CTには被ばくやヨード造影剤腎症などのリスクがあるが,それを上回る利便性や臨床上のメリットもあり,今後さらなるエビデンスの蓄積が求められる。
まとめ
ECVは循環器診療において不可欠なパラメータになってきており,心臓MRIのT1 mappingはルーチン検査に位置づけられる。一方,心臓CTも心臓MRIと同等の遅延造影,ECVの評価が可能になりつつあり,普及が期待される。そして,Ziostation2は,心臓MRIと心臓CTのECV解析が可能であり,実用性が高いツールである。
尾田済太郎(Oda Seitaro)
2004年 久留米大学医学部卒業後,熊本大学医学部附属病院放射線科に入局。2012年 米国MedStar Washington Hospital Centerに留学。2013年 熊本大学大学院生命科学研究部画像診断解析学講座助教。2019年 同講師。熊本大学病院アミロイドーシス診療センター副センター長兼任。
- 【関連コンテンツ】
