技術解説(ザイオソフト)
2021年5月号
循環器領域におけるITの技術の到達点
Post processingがもたらす新たな循環器画像診断技術
下宮 大和[ザイオソフト(株)マーケティング部臨床応用開発グループ]
近年のCTおよびMRI検査は,装置や撮影技術の進歩に伴い,心大血管領域の画像診断において形態評価,機能評価,組織性状評価が可能になり,一度の検査で多くの診断情報を得られるようになった。一方で,装置から得られた多くの画像情報には,高度な画像解析や短時間での画像処理が求められており,多忙な医師や診療放射線技師の業務の中で,医用画像処理ワークステーションは重要な役割を担っている。特に,短時間での画像処理においては,人工知能(AI)の利活用が広く知られているが,「Ziostation2」では,機械学習や深層学習をはじめとするAI技術を応用した独自の認識技術“RealiZe(Recognition of Exact Anatomical Landmark Information with Ziosoft Enhancement)”を多くのアプリケーションで実装しており,短時間での精度の高い血管の抽出や対象臓器のセグメンテーションを実現している。また,当社独自の基幹技術を用いた“PhyZiodynamics”や“心筋ECV(extracellular volume fraction)解析”を用いることで,心筋の機能評価や組織性状評価も可能となり,冠動脈の形態評価に加え,心筋の診断も含めた包括的な心臓検査が行えるようになった。これらは,今後より多くの施設で普及していくことが予想される。
本稿では,心大血管領域におけるZiostation2を用いた形態評価,機能評価および組織性状評価についての技術解説を行うとともに,各アプリケーションの特徴について紹介する。
■心臓CT,MRIにおける形態評価
心臓検査において形態評価と言えば,まず冠動脈評価が挙げられるであろう。冠動脈CT検査では,撮影と合わせてvolume rendering(VR)やcurved planar reconstruction(以下,CPR)の画像構築が有用であり,冠動脈を評価するための画像処理が多くの施設で実施されている。これらの画像処理は,非常に煩雑で時間を必要とするため,以前から心臓全体や冠動脈の自動抽出が望まれていた。従来の冠動脈の抽出ではCT値をベースに行っていたが,Ziostation2では,CT値の情報に加え,心臓の解剖情報と解剖情報から得られた血管の連続性により,従来のCT値のみに依存した処理と比較し,より正確な冠動脈の抽出が期待できる。また,“CT冠動脈バイパス術後解析”では,術後のバイパスグラフトに対しても自動抽出を実行し,データを開くと同時にバイパス血管を認識し,血管のラベリングを可能とした(図1)。
さらに,Ziostation2では,CTだけではなく,MRIで撮像した冠動脈の自動抽出も可能としている(図2)。MRIにおける冠動脈検査は被ばくがなく,造影剤を使用せずに行え,CTと比べより低侵襲で血管の情報が得られること,CTでは評価困難な高度石灰化症例でも血管内腔を描出することができることから注目されている。近年では,compressed sensingを応用した撮像法が注目されてきており,撮像時間の短縮が可能になることから,今後MRIを用いた冠動脈の評価も多くの施設でますます注目されると思われる。
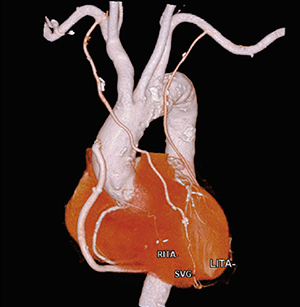
図1 冠動脈バイパス術後患者の自動抽出結果
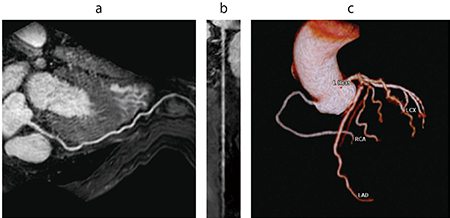
図2 MR冠動脈解析2
a,b:自動抽出された右冠動脈のCPR(a)とs-CPR(b)
c:冠動脈の自動ラベリング
■PhyZiodynamicsを用いた4D画像の診断
PhyZiodynamicsは,当社独自の基幹技術であり,動態補完技術の1つである。モーションコヒーレンスとトラッキングを軸とする複数のアルゴリズムを用いて構成されており,心臓が拍動する4D画像に対し,各ボクセルのトラッキングや仮想的に位相間隔を細かく再構成することが可能になる。心大血管領域においては,装置より得られた時系列データからボクセルの動きを追従し,トラッキングすることで生体の動きを可視化するため,従来の技術では実現できなかった組織の移動量や移動速度を定量値としても算出できる。これにより,昨今では,CTで三次元ストレインも算出可能(W.I.P.)となった(図3)。
ストレイン解析は,ゴールドスタンダードである超音波検査をはじめ,MRIにおいても解析が行われる検査である。PhyZiodynamicsによる“CTストレイン解析”では,心臓の機能解析を行うために撮影された1心拍の心臓データを利用するため,新たに特殊な撮影を追加する必要がない点が特徴の1つである。PhyZiodynamicsにより,1心拍のCTデータに対してボクセルベースのトラッキングを行い,各心筋組織の変形量を求め,歪み(ストレイン)を定量化する。これにより壁厚の変化量のみの解析ではなく,心筋組織が歪みを伴いながら運動しているのかどうか,言い換えれば,心筋そのものが正常に伸縮しているのかどうかを三次元的に求めることが可能になった。
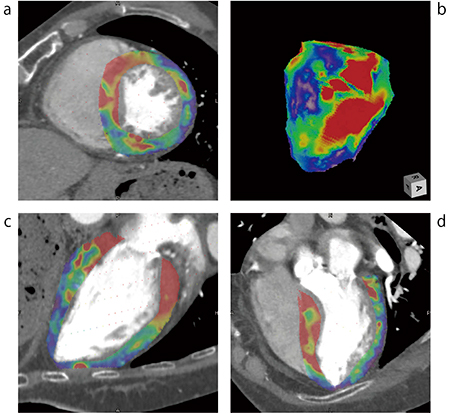
図3 CT画像を用いたmaximum principal strain(最大主歪み)
a:SAフュージョン b:VRフュージョン
c:4chフュージョン d:LAフュージョン
■心筋性状をECVで見る
循環器領域におけるイメージングにおいて,心筋の線維化を評価することが,治療方針の決定や予後予測の上で重要とされている。これは,心筋の線維化は心筋障害と密接に関係しており,心筋障害が起こると間質に線維化が生じてしまうためである。この線維化の指標は,MRIを用いたピクセルごとのT1値を計算することで得られるT1マップ,また,得られたT1値とヘマトクリット値を利用することで求められるECVマップで評価することができる1),2)(図4)。
しかしながら,MRIでの心筋の評価は,体内金属を有している患者へ検査が実施できないことや,撮像時間が長いため検査枠の確保などの課題がある。近年では,CT装置技術の進歩により,低管電圧撮影と逐次近似画像再構成を併用し,容易に高コントラストかつノイズの少ない画像の取得が可能となったことで,CT画像を用いたECV評価が注目されている。さらに,dual energy CTで撮影し,低keVで生成した仮想単色X線画像を用いることで,遅延相のコントラスト分解能も向上し,MRIと同等の評価が可能になってきた。加えてZiostation2の最新バージョンでは,ヨードマップにも対応した解析が行える。CTを用いたECV解析は,MRIと比較して検査枠の確保が容易であることや,従来の心臓CTに遅延相を追加するだけでECVを得られることも,実臨床では非常に有用である3),4)(図5)。
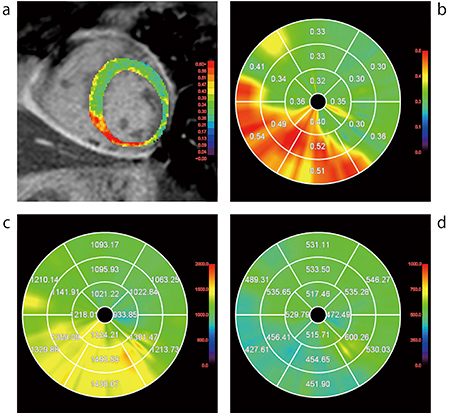
図4 MR心筋T1マッピング
a:ECV b:ECVマップ
c:Native T1マップ d:T1マップ
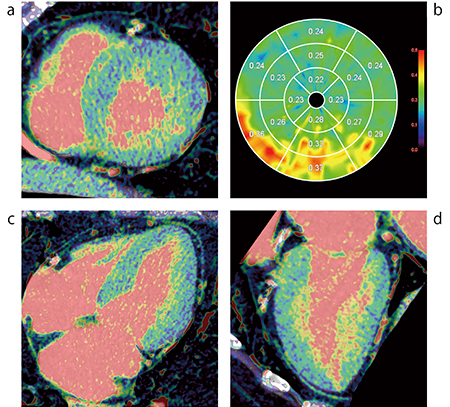
図5 CT心筋ECV解析
a:SAフュージョン b:ブルズアイマップ表示
c:4chフュージョン d:LAフュージョン
◎
本稿では,Ziostation2を用いた新たな循環器画像診断技術について紹介した。高い精度で血管の抽出や対象臓器のセグメンテーションを短時間で行うことを可能としたRealiZe,従来の形態情報だけではわからなかった組織の動的変化量を定量値として算出することを可能としたPhyZiodynamicsをはじめ,新たな画像診断として組織の性状を評価する指標であるECVについて解説した。
近年注目されている報告では,新型コロナウイルス感染症(COVID-19)から回復した患者の多くに心筋障害が発症することも言われており,今後ますます循環器領域における画像診断は重要視されてくるであろう5)。ザイオソフトは,これからも独自の技術で診断に役立つ製品を開発し続け,医療に貢献していきたいと考えている。
●参考文献
1)Philip, H., et al. : Cardiac T1 Mapping and Extracellular Volume(ECV)in clinical practice : A comprehensive review. J. Cardiovasc. Magn. Reson., 18 : 89, 2016.
2)Messroghli, D.R., Moon, J.C., Ferreira, V.M., et al. : Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume : A consensus statement by the Society for Cardiovascular Magnetic Resonance(SCMR)endorsed by the European Association for Cardiovascular Imaging(EACVI). J. Cardiovasc. Magn. Reson., 19(1) : 75, 2017.
3)Ohta, Y., Kitao, S., Watanabe, T., et al. : Measurement of Myocardial Extracellular Volume Fraction From Iodine Density Images Using Single-Source, Dual-Energy Computed Tomography : A Feasibility Study. J. Comput. Assist. Tomogr., 41(5) : 750-756, 2017.
4)Oda, S., et al. : Myocardial Late Iodine Enhancement and Extracellular Volume Quantification with Dual-Layer Spectral Detector Dual-Energy Cardiac CT. Radiol. Cardiothorac. Imaging, 1(1): e180003, 2019.
5)Puntmann, V.O., et al. : Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019(COVID-19). JAMA Cardiol., 5(11):1265-1273, 2020.
●問い合わせ先
ザイオソフト株式会社
マーケティング部
〒108-0073
東京都港区三田1-4-28
TEL:03-5427-1921
http://www.zio.co.jp
