Embarking on A New Era of Computed Tomography
– Spectral shaping, Quantification, and Counting
伊藤俊英(シーメンスヘルスケア株式会社ダイアグノスティックイメージング事業本部CTリサーチ&コラボレーション部)
Session Ⅴ Technological Innovations of SOMATOM CT
2018-11-22

本講演ではスズ合金(Sn50)のTin filterによるSpectral Shapingの原理とその効果,CTスキャナの将来技術として現在研究開発を進めているPhoton Counting Detectors CT(PCD-CT)の特徴,そして,CTにおける重要課題の一つである定量性について言及する。
Tin filterによるSpectral Shaping
1.Spectral Shapingの原理
Siemens Healthineers独自の技術であるTin filterは,厚さ0.4〜0.6mmの可動式物理フィルタであり,主に60keV以下のX線エネルギーを選択的に減弱させる効果がある。X線スペクトルの重心を高keV側にシフトさせて実効エネルギーを引き上げるほか,スペクトルの帯域幅を狭小化させ,結果として減弱長の変化に対しても直線的なCT値の変化をもたらす。
2.Tin filterの物理的な効果
X線スペクトルは,透過する物質が厚くなるほど線質硬化の影響を受ける。管電圧120kV,100kV, Sn100kV(Tin filterありの100kV)について,段階的に厚みを変化させた肝実質等価物質を透過したX線スペクトルを比較したところ,Sn100kVでは減弱長が増加してもスペクトルの重心位置,および,その形状が大きく変化しなかった(図1)。
また,肝実質と希釈ヨード造影剤において,X線の減弱長(50〜500mm)に対するSn100kV,Sn150kVの実効エネルギーの変化を調べたところ,いずれの物質,管電圧においても120kVと比べて実効エネルギーの変化率が少なかった。その結果,CT値に関しても減弱長に対する変化量が少なく,直線的な変化を示した。
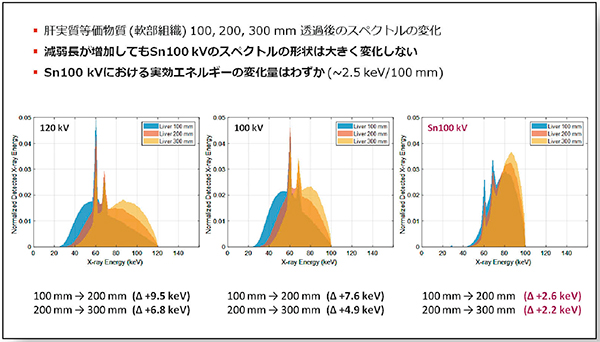
図1 Tin filterによるスペクトルの変化
3.Tin filterと画質の関係
同一管電流における100kV,70kV,Sn100kVの照射フォトン量を比較すると,Sn100kVは100kVの約8%,70kVの約34%となる(図2 a)。つまり,最低管電流20mAにおけるSn100kVの実質的な管電流は1.6mAとなり,これは照射線量0.07mGyに相当する。X線管にとって低管電流値を安定して連続照射するのが比較的難しいことを考えると,Tin filterは少ない照射線量を実現するスマートなテクノロジーであることがわかる。
一方で,同等の照射線量(フォトン数)であればノイズ量もほぼ同等になることが漠然と期待されるが,Tin filterを通したX線スペクトルは,その形状のユニークさによってノイズ量も特異的な性質を示す。直径300mmの水ファントムに対して同等の照射線量で70kVとSn100kVのノイズ量をNPSによって比較した場合,Sn100kVのノイズ量は70kVのわずか48%であり,70kVに強度5のADMIREを適用したノイズ量よりもやや低い値を示した(図2 b)。Tin filterによって低線量でも低ノイズの画質が得られ,高い被ばく低減効果が期待できることを示している(図3)。
加えて,非造影検査においてSn100kVによる低線量撮影(<2.5mGy)を考えた場合,120kVと比較して筋肉や肝実質,肺などの軟部組織においては,CNRで約10〜15%の利得が得られる(図4上段)。これはモンテカルロシミュレーションによる吸収線量の比較結果からも理解することができるが,Sn100kVは他の管電圧よりもファントムの中心部までエネルギーを運搬する能力が高いことを反映している(図4下段)。
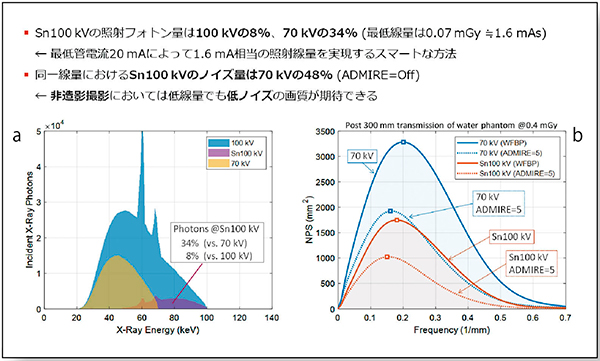
図2 照射フォトン量とノイズ量の比較
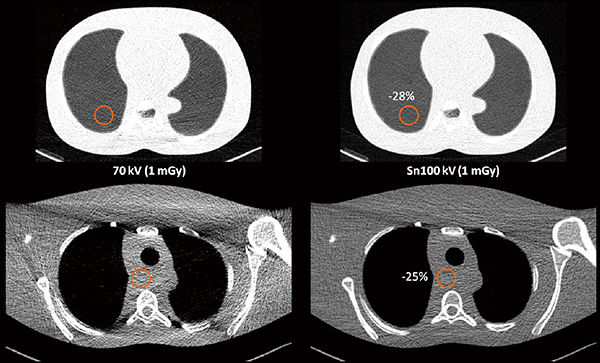
図3 Sn100kVによる肺の超低線量CT(1mGy)のファントム画像
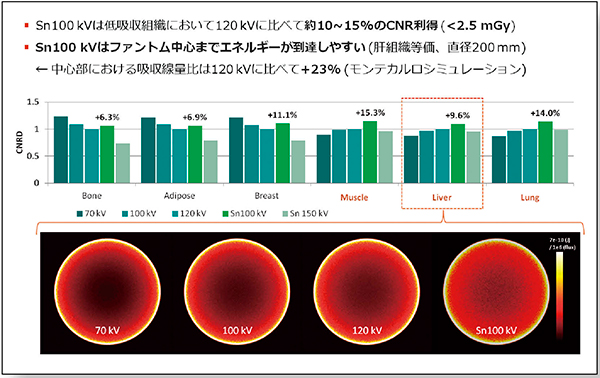
図4 低線量撮影時のCNRDと吸収線量
4.DECTにおけるTin filterの効果
Dual Energy CT(DECT)の高kV側にTin filterを実装する第一の利点は,実効エネルギーのセパレーションをより大きくできることにある。「SOMATOM Force」における80kV/Sn150kVのエネルギー差は47keVにもなるが,これはエネルギー差が17keV程度の80kV/140kVの約3倍に相当する。また,スペクトルのオーバーラップを大幅に少なくし,DE解析に貢献しない被ばくを低減できるという第二の利点ももたらす。
さらに,Tin filterはDECTにおける定量解析精度にも重要な役割を果たしている。すでにTin filterによる物理的な効果として,軟部組織とヨード造影剤の減弱長変化に対するCT値変化の直線性を示したが,DECTにおいてはTin filterによって高kV側の直線性が担保されることで,それを補正基準にしたマテリアルデコンポジションが可能となり,ヨードの定量解析精度が向上することがわかっている。これは,DECTにTin filterを用いることの大きなアドバンテージとなっている。
Photon Counting Detectors CTの可能性
1.PCDの原理
現在,CTで採用されているシンチレータ検出器は,エネルギー積分型検出器(EID)とも呼ばれている。検出器に入射したX線をシンチレータによって光に変換し,それをさらにフォトダイオードによって光電流に変換し最終的な計測信号にしている(図5 a)。EIDは入射X線のエネルギー強度が光電流の強度に比例するため,相対的に低エネルギーの情報が過小評価される特性がある。一方,PCDは,入射したX線がセンサ内部に電子・正孔対を発生させ,電子をアノードピクセルに掃引し,パルスとして個々にカウントすることで,X線の強度とエネルギーを検出する仕組みになっている(図5 b)。
現在,Dual Source CT「SOMATOM Definition Flash」の片方の検出器をテルル化カドミウム(CdTe)のPCDユニットと装換した研究用プロトタイプスキャナを開発し,米国の2施設においてその特性を広く研究している。
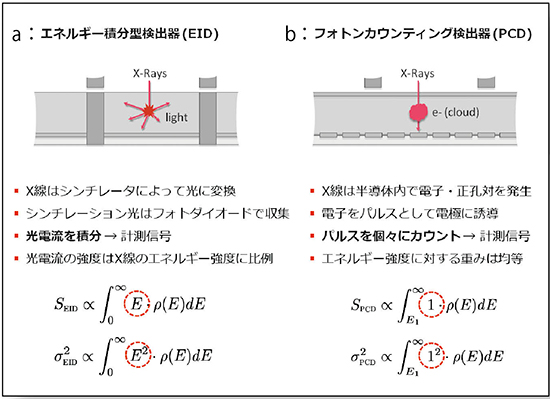
図5 EIDとPCDの原理
2. PCDの特徴と課題
PCDの代表的な特徴は,(1)検出器からの電気ノイズの影響を計測信号から除去できるため,低線量撮影でも低ノイズ画像が得られること,(2)相対的に低エネルギー側に対する感度が高いため,軟部組織やヨード造影剤におけるコントラストが高くなる,(3)単一検出器で複数のX線エネルギーを計測できるため,K吸収端イメージングが可能となる,そして,(4)空間分解能はアノードピクセルの最小サイズとして規定できるため,高空間分解能撮影が容易であることなどである。
一方,PCDには,高線量撮影時のPulse PileupやCharge Sharingなどによる非線形性の計測エラーがある。これらへの対策は重要な研究テーマのひとつである(図6)。
PCDはEIDのような検出器素子間の物理的な隔壁が不要なため,幾何学的な線量効率は100%に達する。センサのアノードをマイクロピクセル化することと,計測信号から能動的にノイズ除去が可能なことは,いずれも高分解能撮影に有利である1)。
さらに,PCDは複数のエネルギーを同時に計測できるため,K吸収端イメージングによるマルチマテリアルイメージングが可能である。例えば,ガドリニウム造影剤とヨード造影剤の2剤を使用したマルチマテリアルイメージングは,ダイナミックにガドリニウム造影剤とヨード造影剤を注入したperfusionデータから,それぞれガドリニウムとヨードの分布の変化を画像化することが可能となっている2)。定量精度は良好であり,さらなる研究の発展が期待できる。
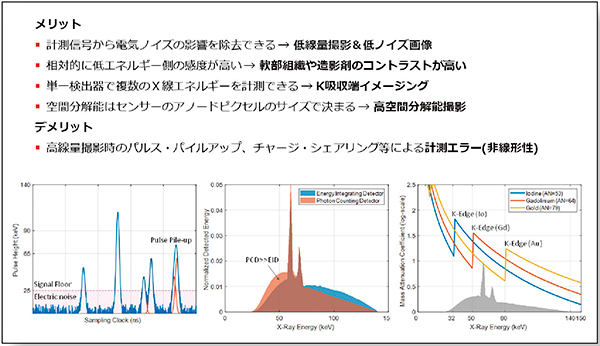
図6 PCD-CTの特徴
3.K吸収端イメージングの可能性と課題
K吸収端イメージングは,DECTにはないPCD-CT特有の技術である。K吸収端の位置(エネルギー値)は個々の元素に固有であることから,さまざまな元素を指標にしたイメージングが期待される。しかし,X線管から照射されるエネルギーが20〜160keV程度であることを考えると,その対象となるのはヨードやガドリニウム,金などの重金属元素に限られ,例えば,生体を構成するナトリウム,リン,カルシウムなどは,K吸収端イメージングの対象外となる。仮にK吸収端に依存しないのであれば,エネルギーのセパレーションが大きいTin filter搭載のDECTの方が優位と考えられる。実際に,カルシウムや鉄のようにPCD-CTのK吸収端イメージングの対象外の元素はもちろんのこと,金などのようなさらに原子番号が高い元素もDECTのイメージングの対象となっている。
Tin filterを搭載したDECTによる,プラチナ(Pt78)を配する抗がん剤「シスプラチン」の定量解析では,シスプラチンの濃度を0,0.5,1,2,3mg/mL,ヨードの濃度を0,1,2mg/mLと変化させた混合物質を,改良したマテリアルデコンポジションによって分離することに成功している3)。この時のシスプラチンの最低濃度は0.5mg/mLであり,実臨床に期待ができる結果が得られている。
まとめ
精度の高い定量解析には,線形性の高い計測データを収集する「計測装置」としてCTスキャナを設計開発する技術が求められる。
SOMATOM CTに共通した設計思想は,精密な「計測装置」としてCTスキャナを開発することであり,次世代CTとして期待されているPCD-CTにおいても,その思想が継承されている。
●参考文献
1)Pourmorteza, A., et al., Invest. Radiol., 53・6 365〜372, 2018.
2)Symons, R., et al., Med. Phys., 44・10, 5120〜5127, 2017.
3)Sofue, K., Itoh, T., et al., Invest. Radiol., 53・11, 673〜680, 2018.
- 【関連コンテンツ】
