セミナーレポート(キヤノンメディカルシステムズ)
第74回日本医学放射線学会総会が4月16日(木)〜19日(日)の4日間,パシフィコ横浜(横浜市)にて開催された。18日に行われた東芝メディカルシステムズ株式会社共催のランチョンセミナー11では,埼玉医科大学国際医療センター画像診断科教授の木村文子氏を座長に,慶應義塾大学医学部放射線科学教室助教の山田祥岳氏,神戸大学大学院医学研究科先端生体医用画像研究センターセンター長/内科系講座放射線医学分野機能・画像診断学部門部門長・特命教授の大野良治氏,宮崎大学医学部病態解析医学講座放射線医学分野教授の平井俊範氏が,「次世代面検出器CTの最新臨床応用」をテーマに講演した。
2015年7月号
第74回日本医学放射線学会総会 ランチョンセミナー11 次世代面検出器CTの最新臨床応用
頭部・頸部領域における320列面検出器CTの臨床応用 ─脳腫瘍への応用とSEMARの使用経験─
平井 俊範(宮崎大学医学部病態解析医学講座放射線医学分野)
東芝メディカルシステムズ社製の320列ADCTでは,1回転16cmの撮影で全脳をカバーできるほか,AIDR 3D併用のDynamic Volume Scanによって,単純CT,CT Angiography(CTA),CT Venography(CTV),Surface Anatomy Scan(SAS),CT Perfusion(CTP),4D CTAを得ることができる。造影3D CTAと同等の被ばく線量で,しかも,1分間で20回の撮影により最適時相での形態情報および機能情報を取得できることは,大きなメリットである。
本講演では320列ADCTの臨床応用として,(1)脳腫瘍への応用,(2)脳血管病変への応用,(3)金属アーチファクト低減アルゴリズム“SEMAR”の使用経験について述べる。
脳腫瘍への応用
1.脳実質外腫瘍
症例1は,40歳代,女性,傍矢状洞の髄膜腫症例である。MRAではfeeder(栄養血管)と付着部の評価が可能であるが,血行動態情報がない,空間分解能はDSAに劣るという欠点がある。一方,320列ADCTのDynamic Volume Scanでは,4D CTAにて中硬膜動脈由来のfeederが早期に描出でき,CTA,CTVおよびフュージョン画像にて,動静脈と腫瘍との関係を明瞭に把握できる。VR画像では,付着部における腫瘍,静脈,feederの位置関係が一目瞭然であり(図1),MRAでは得られない末梢の情報を取得できた。
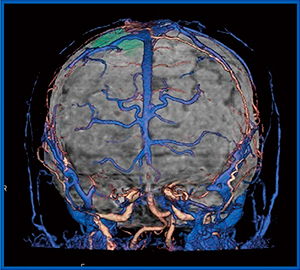
図1 症例1:傍矢状洞髄膜腫症例
症例2は,70歳代,女性,髄膜腫症例である。Dynamic Volume Scanでは通常,最初に2秒おきに計16回の間欠撮影を行うが,“PhyZiodynamics”(ザイオソフト社)の5倍密phase生成を用いて時間軸方向に5倍の密度で補間を行うと,通常の4D CTAよりも明瞭にhemodynamicを確認できる。4D Perfusionも作成可能であり,hypervascularな腫瘍の診断に有用である(図2)。
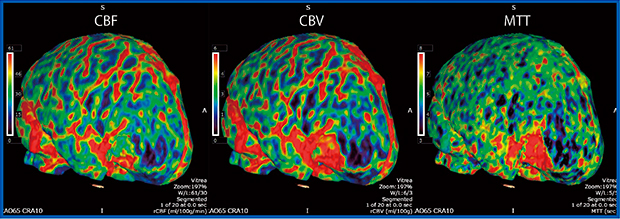
図2 症例2:髄膜腫症例
2.脳実質内腫瘍
症例3は,60歳代,女性,膠芽腫症例である。4D CTAにて非常にvascularityの高い病変が描出され,CTA,CTV,SASのフュージョン画像にて動脈,静脈と腫瘍の位置関係を明瞭に把握することができる(図3)。本症例では,この画像を基に手術時に早期に動脈を処置することで,腫瘍の全摘が可能であった。
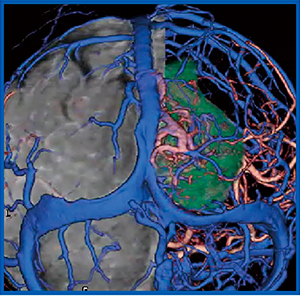
図3 症例3:膠芽腫症例
3.脳腫瘍の術前評価─320列ADCTはMRIへの付加情報があるか?
脳腫瘍の診断では通常,MRIでほとんどの情報が得られるが,320列ADCTを施行することでどのような有用性が付加できるか検討した。
当院の16症例について,CTとMRIの比較を行ったところ,feederや静脈についてはCTの方が多くの情報を提供していた。パーフュージョンについてはCTとMRIで良い相関が得られており,1症例のみ,MRIでは腫瘍内の出血のため評価不能であったが,CTでは評価可能であった。また,外科治療においては16症例中13症例(81%)に付加情報があり,そのうち5症例は治療に有用だった。この内訳を見ると,4症例で富血管性腫瘍の切除に有用な血管情報が取得でき,1症例で術前MRIでは鑑別不能な脳実質内・実質外腫瘍の鑑別が可能であり,320列ADCTは脳腫瘍の治療に有用と思われた。
脳血管病変への応用
症例4は,70歳代,女性,内頸動脈瘤のため2か所にバイパス術が施行された。術後4D CTAでは,バイパスした血管と母血管,末梢血管との関係が明瞭に描出され,VR画像でもhigh flow bypassや骨と血管との関係が確認できた(図4)。
また,脳梗塞の診断に当たっては,さまざまな検討が必要となるが,Variable Helical Pitch scanを用いることで,10秒程度で冠動脈を含めた心臓および頸動脈,脳動脈の情報が取得でき(図5),血管内プラークの評価も可能である(図6)。一度の検査でこれらの情報をすべて得られるため,きわめて有用である。
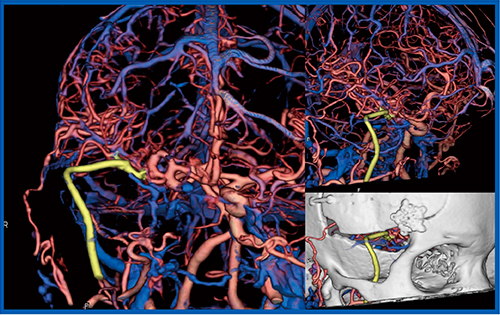
図4 症例4:内頸動脈瘤バイパス術後症例
黄色はhigh flow bypass
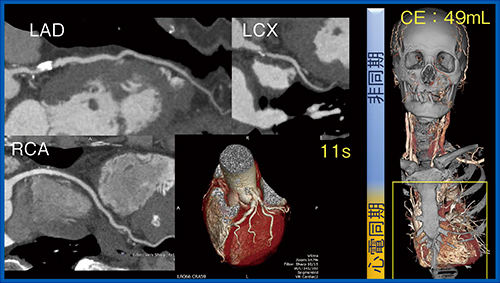
図5 Variable Helical Pitch scanによる冠動脈の評価
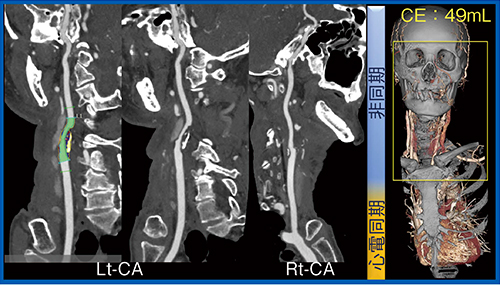
図6 Variable Helical Pitch scanによる血管内プラークの評価
SEMARの使用経験
SEMAR(Single Energy Metal Artifact Reduction)は,金属アーチファクト成分のみを効果的に除去する技術である。通常,脳動脈瘤のコイル塞栓術後はCT適応外となるが,SEMARの併用により金属からの強いストリークアーチファクトが低減し,周辺の血管情報を明瞭に把握することが可能である(図7)。
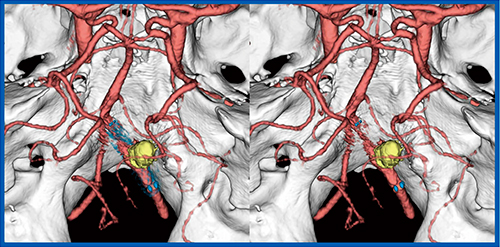
図7 脳動脈瘤コイル塞栓術後のSEMAR併用3D CTA
また,頭頸部においては義歯によるアーチファクトが問題となるが,SEMARを用いることで大幅な軽減が可能である。症例5は,30歳代,男性,下顎の骨肉腫術後再発であるが,SEMARにより義歯のアーチファクトが除去され,3D CTAで明瞭に評価可能であった(図8)。この画像にて腫瘍に流入する血管の残存が確認でき,超選択的動注化学注療法が施行された。図9は,治療時のDSA画像との比較であるが,SEMAR併用の3D CTAでも同様の画像が得られていることがわかる。腫瘍に向かう血管が明瞭に描出できている。
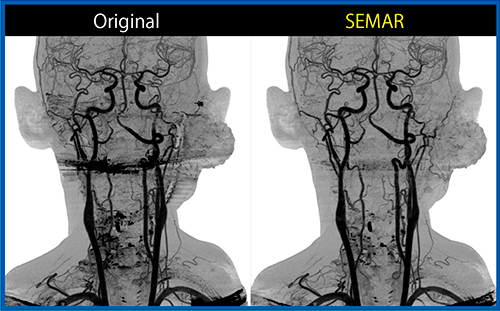
図8 症例5:下顎の骨肉腫術後再発における動注治療前のSEMAR併用サブトラクション3D CTA
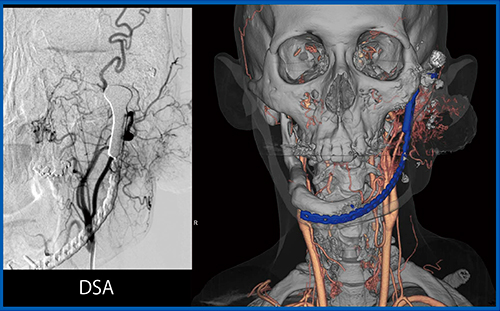
図9 症例5:動注治療時のSEMAR併用サブトラクション3D CTA
まとめ
AIDR 3D併用の320列ADCTは,1分程度のDynamic Volume Scanにより,低被ばくで形態・機能情報が得られる。脳腫瘍や脳血管障害の診断に有用であり,今後,臨床への有用性が期待される。
SEMARは金属アーチファクトを低減し,術後や頭頸部の評価に有用と思われる。

平井 俊範(Hirai Toshinori)
1989年 熊本大学医学部卒業。同放射線科入局。1996年 米国留学。2005年 熊本大学医学部放射線診断科講師。2006年同准教授を経て,2015年より宮崎大学医学部病態解析医学講座放射線医学分野教授。
- 【関連コンテンツ】
