セミナーレポート(キヤノンメディカルシステムズ)
2016年4月21日(木)~23日(土)の3日間,第102回日本消化器病学会総会が京王プラザホテル(東京都新宿区)を会場に開催された。22日(金)には,東芝メディカルシステムズ株式会社共催のランチョンセミナー21が行われた。今井康晴氏(東京医科大学八王子医療センター消化器内科教授)が座長を務め,「Aplioによる肝臓腫瘍診断の最前線」をテーマに,杉本勝俊氏(東京医科大学消化器内科講師)と麻生和信氏(旭川医科大学内科学講座病態代謝内科学分野講師)が講演した。
2016年7月号
第102回日本消化器病学会総会ランチョンセミナー21 Aplioによる肝臓腫瘍診断の最前線
肝癌における造影エコー法の新展開 ─造影Smart 3Dの臨床応用─
麻生 和信(旭川医科大学内科学講座病態代謝内科学分野)
近年の画像処理技術の向上により,ソナゾイド造影エコー法(造影US)は目覚ましい進歩を遂げた。それは,従来の造影ハーモニック法の画質向上にとどまらず,高速・高画質な造影三次元エコー法(造影3D)や,時間・空間分解能に優れたカラードプラ法の実用化など新たな展開を生み出している。
東芝メディカルシステムズ社が開発した“Superb Micro-vascular Imaging (SMI)”は,カラードプラのモーションアーチファクトを制御した画期的な撮像法であり,造影SMIでは空間分解能とリアルタイム性を両立しながら,血流情報のみを選択的に評価することが可能となっている。さらに,“Smart 3D”はSMIに特化した新たな造影3Dモードであり,造影3Dの先駆けである“Fusion 3D”1)の技術を発展させ,Bモードの組織像と造影ドプラの血流像からなるvolume rendering(VR)画像を高速で作成し,高精細な立体像として表現することができる。そこで,本講演では肝癌における造影Smart 3Dの臨床応用について,われわれの使用経験を基に概説する。
肝癌診断における造影3Dの意義
造影USは,肝癌の存在診断,質的診断,治療支援などさまざまな面で有用性が報告されているが,通常用いられる造影二次元エコー法(造影2D)は,超音波特有の術者依存や客観性などいくつかの問題点が指摘されている。造影3Dは,こうした課題を解決するために研究開発が進められ,現在では画像処理の進歩により高速・高画質な造影3Dへと発展している。
肝癌診断における造影3Dの意義は,ボリュームデータの利用による客観性の向上と,腫瘍や血管の立体表示による診断能の向上である。すなわち,造影3Dではraw data保存されたボリュームデータを用いて,検査医以外の第三者が任意の画像を随時表示することが可能であり,造影2Dに比べ客観性が保たれている。また,造影2Dにおける血流評価では,通常は腫瘍の一断面を観察するのに対し,造影3Dでは立体的に表現された腫瘍血管を多方向から観察することで,腫瘍の全体像のみならず腫瘍と周囲脈管との位置関係まで広く観察することが可能である。その一方で,従来の3D専用プローブや造影ハーモニック法に関する課題として,汎用プローブに比べ高価であることや,内部エコーレベルの高い腫瘍では血流評価に課題が残ることなどが挙げられている。
造影Smart 3Dの特長と従来法との比較
従来のメカニカル3Dプローブを必要とする造影3D(従来法)と比べ,造影Smart 3Dは肝癌の臨床応用に適した以下の特長を備えている。(1) 汎用コンベックスプローブによる扇動走査で容易にボリュームデータを取得できる。(2) 高速画像処理により,データ取得後速やかに高精細な3D画像を表示できる。(3) 造影SMIに対応し,血流像のみを選択的に立体表示できる。(4) 血流と組織を一体化させたSmart 3D表示を備えており,腫瘍血流と腫瘍実質の両面から立体的評価を行うことができる。
造影Smart 3Dの画像再構成は,MPRを参照しながら立体像を構築するという点で,従来法との大きな違いはないが,従来法ではMIPによる血管表示が主流であるのに対し,造影Smart 3DではVRによる血管表示が適している。また,Smart 3Dの画像表示は血流のみの選択的表示(図1 a)や,血流と組織の合体表示(図1 b)など多彩な組み合わせが存在するが,これらすべてを表示させるには,あらかじめcolor-coded SMI(cSMI)でボリュームデータを取得しておく必要がある。なお,Smart 3Dは正確な位置情報は持たないため,計測などに使用することはできない。
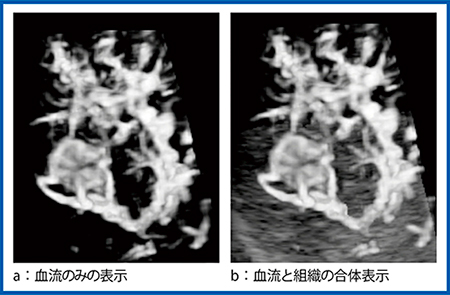
図1 造影Smart 3Dの画像表示
今回,肝癌の精密診断に造影Smart 3Dを応用し,従来法との比較検討を行った。対象は2016年3月までに造影Smart 3Dを施行した肝細胞癌(HCC)18症例22結節で,全例が肝硬変を有していた。腫瘍径中央値は17.5mm(8.0〜99.4mm),腫瘍深度中央値は6.9cm(3.0〜11.7cm)であった。腫瘍の内部エコーレベルは32%が高エコーを呈した。撮像条件と撮像プロトコールの詳細を,図2,3にそれぞれ示す。画像評価は,大藤らの報告した造影3Dによる肝腫瘍の診断基準1)に準じて行った。評価項目は,
(1) 造影Smart 3Dの血流診断能,(2) 造影Smart 3Dの血管描画性,(3) 造影Smart 3Dによる治療効果判定であり,(1),(2)は従来法と比較し,(3)は造影2Dを用いたDefect Re-perfusion Imaging(DRP)2)と比較検討した。その結果,22結節すべてで造影Smart 3Dによる血流評価は可能と判定された。このうち,未治療の5結節について非造影Smart 3Dと血流検出率を比較した結果,非造影の血流検出率20%に対し,造影Smart 3Dでは100%と,造影後明らかに血流検出率は向上した。また,従来法との比較では,血流診断能に差は認めず,血管描画性については造影Smart 3Dの方が有意に優れているという結果を得た(図4)。
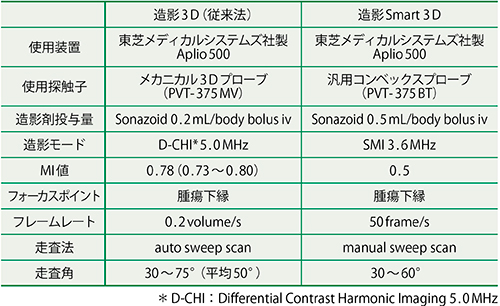
図2 撮像装置と撮像条件
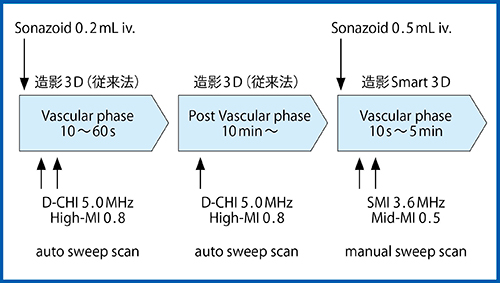
図3 撮像プロトコール
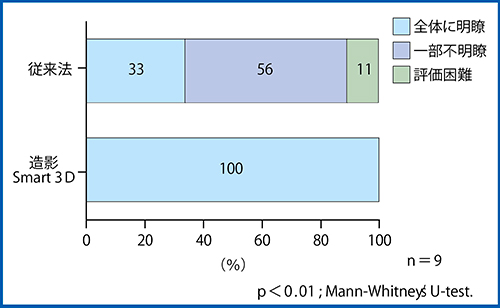
図4 肝癌における血管描画性の比較
症例提示
実際の症例を提示する。図5は,C型肝硬変に合併したS4,20mmのDEB-TACE施行後のHCC症例である。造影CT(図5 a,b:←は腫瘍部)では不整な濃染像と染まり抜けを認め,HCC再発と診断された。Bモード(図5 c)では内部エコーレベルの高い腫瘍として同定された。造影Smart 3D(図5 d, e)では,不整な腫瘍血管と既存の脈管構造が明瞭に描出され,腫瘍の全体像のみならず腫瘍と脈管の位置関係まで明確にすることができた。
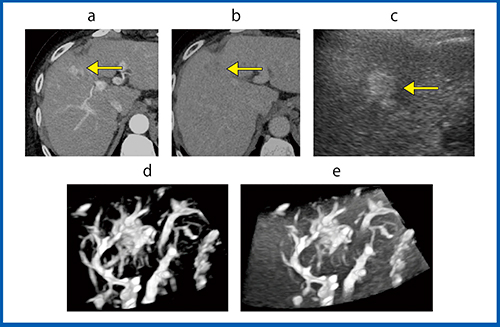
図5 C型肝硬変に合併したDEB-TACE施行後のHCC症例(70歳代,女性)
図6は,NASH肝硬変に合併したS5, 52mmのHCC症例である。EOB造影MRI(図6 a,b)では,不整な濃染形態を示し,多結節癒合型HCCと診断された。Bモード(図6 c)では,腫瘍内に高エコー領域を伴った境界不明瞭な腫瘍として描出された。従来法の造影3D(図6 d)では組織シグナルの影響により腫瘍内血管は不明瞭であったが,造影SMI(図6 e)では腫瘍内血管は明瞭に描出され,造影Smart 3D(図6 f)では腫瘍血管の連続性が向上し,HCCに特徴的なNetwork pattern(網目状の腫瘍内血管像)を呈した。
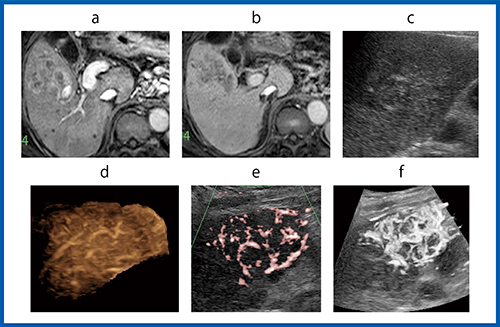
図6 NASH肝硬変に合併したHCC症例(60歳代,男性)
図7は,B型肝硬変に合併したS5,49mmのHCC症例である。造影CT(図7 a,b)では均一な腫瘍濃染と染まり抜けを認め,HCC典型例と診断された。Bモード(図7 c)では腫瘍の内部エコーレベルは高く,そのため従来法の造影3D(図 7 d)では腫瘍内血管は不明瞭であった。一方,造影SMI(図7 e)では腫瘍内血管が描出され,造影Smart 3D(図7 f)では腫瘍血管の連続性が向上し,きわめて高精細な腫瘍内血管像が描出された。
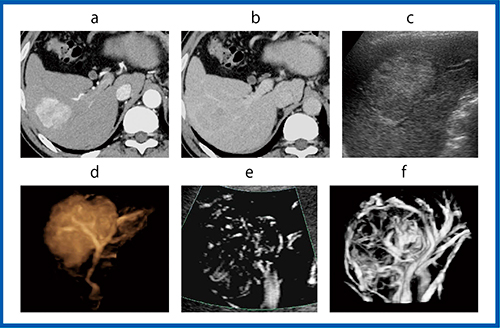
図7 B型肝硬変に合併したHCC症例(60歳代,男性)
図8は,B型肝硬変に合併したS6, 15mmのHCC症例である。本症例は肝切除が施行され,肉眼型は単純結節型,組織型は内部に脂肪化を伴った高〜中分化型HCCと診断された(図 8 a,b)。術前のBモード(図8 c)では内部エコーレベルの高い類円形腫瘍として描出され,後方エコーの減弱と外側陰影を伴っていた。高周波プローブによる造影MFI(図8 d)では,組織エコーの影響により腫瘍の血流評価は困難であったが,造影Smart 3D(図8 e)ではHCCに特徴的なNetwork patternを認め,進行HCCと診断できた。
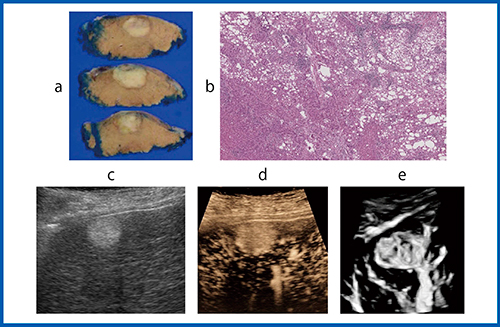
図8 内部に脂肪化を有するHCC症例(70歳代,女性)
造影Smart 3Dによる治療効果判定
当院では,肝癌局所療法の治療効果判定にDRPを用いて評価を行っている。図9に,その判定基準を示す。このうち,治療前の腫瘍径が治療後のdefect径を上回り,かつDRP陰性の場合は完全壊死と判定し治療終了,DRP陽性の場合は不完全壊死とし追加治療を行っている。また,治療前の腫瘍径が治療後のdefect径と同等かつDRP陰性の場合,リング状濃染と判定し慎重な経過観察を行っている。こうした基準を基にDRPとSmart 3Dの比較を行った結果,両者の判定に差は認めなかった。
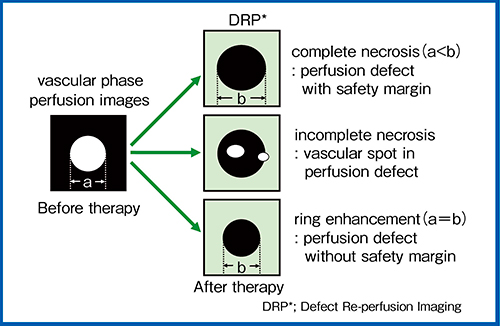
図9 DRPを用いた肝癌治療効果判定
図10は,B型肝硬変に合併したS5, 8mmのBモード検出不能HCC症例である。EOB造影MRI(図10 a , b:←は腫瘍部)では動脈相で高吸収,肝細胞相で低吸収を呈しHCCと診断された。治療前のDRP(図10 c)は陽性,RFA治療3日後のDRPは陰性と判定された(図10 d)。造影Smart 3Dにおいても,治療前に認めた腫瘍血管はすべて消失していることが確認された(図10 e,f:←は腫瘍部,▶は治療部)。
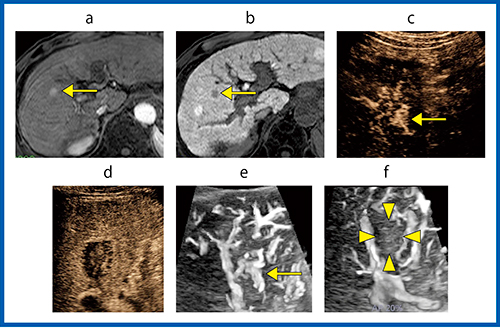
図10 B型肝硬変に合併したBモード検出不能HCC症例(70歳代,男性)
◎
肝癌における造影Smart 3Dの臨床応用について,われわれの初期経験を基に概説した。造影Smart 3Dは造影SMIの血流情報を高精細な立体像として表現できるため,従来の造影ハーモニック法を補完する意味で重要であり,臨床的には高輝度結節の血流評価,肝癌局所療法の治療効果判定などに有用性が示唆される。
●参考文献
1)Ohto, M., et al. : Vascular flow patterns of hepatic tumors in contrast-enhanced 3-dimensional fusion ultrasonography using plane shift and opacity control modes. J. Ultrasound Med., 24・1, 49〜57, 2005.
2)工藤正俊・他:肝細胞癌治療支援におけるSonazoid造影エコー法の新技術の提唱 ; Defect Re-perfusion Imagingの有用性. 肝臓, 48, 299〜301, 2007.

麻生 和信(Aso Kazunobu)
1992年 愛知医科大学卒業。同年旭川医科大学医学部内科学第二講座入局。函館協会病院,札幌厚生病院消化器科,渓和会江別病院,旭川医科大学医学部内科学第二講座助手,同病態代謝内科学分野学内講師などを経て,2011年〜同講師。
- 【関連コンテンツ】
