セミナーレポート(キヤノンメディカルシステムズ)
2016年8月号
Ultrasonic Week 2016ランチョンセミナー8 新イメージング技術
2D-Shear Wave ElastographyによるDispersion(粘性)Imaging
森安 史典(国際医療福祉大学/山王病院 がん局所療法センター)
新製品の「Aplio iシリーズ」では,がん局所療法のナビゲーションとして有用な“Fusion Imaging”と“Smart Navigation”が進化したほか,2D-Shear Wave ElastographyによるDispersion(粘性)Imaging(W.I.P.)が可能となった。本講演では,Dispersion Imagingの特徴と有用性を中心に述べる。
Fusion ImagingとSmart Navigationの進化
1.Navigation Systemとしての活用
Aplio iシリーズでは,プローブに加え穿刺針にも磁気センサを取り付けられるので,Fusion Imagingと穿刺針のナビゲーション(Smart Navigation)が同時に可能である。山王病院がん局所療法センターでは膵がん・肝がんのナノナイフ治療を実施しているが, Fusion Imagingにて超音波画像とCT画像を並列表示し,超音波では確認しづらい胃や十二指腸あるいは大腸のガスに妨げられる部分でも,CT画像を参照することで正確かつ安全に穿刺可能となる。さらに,Smart Navigationを使用することで,針先の到達位置を正確に把握することができる。
2.“MPR-CT”-US Fusion Imaging
Fusion Imagingにおいては従来,超音波のリアルタイムの画像とMPR-CT画像の同じ断面(A面:図1 c,d)が表示されていたが,Aplio iシリーズではMPR-CT画像のC面(図1 a:図1 cのーで切った断面)も併せて表示可能となった。さらに,3Dボディーマーク(図1 b)が表示されるため,プローブの走査断面が把握しやすく,これにより正面からの穿刺時にその周辺の臓器や血管の位置が非常に理解しやすくなっている。
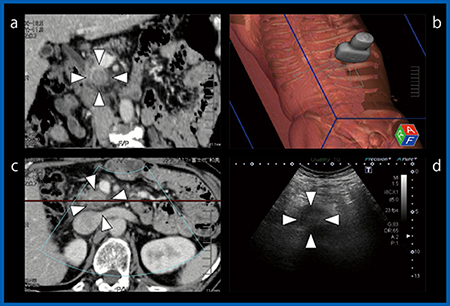
図1 MPR-CT vs. US Fusion Imaging
リアルタイム超音波(d)のみでは,腫瘍部のみわかるが周囲の状況がわからないため,穿刺には危険である。cはdと同じ断面であるが,腫瘍とその周辺の緒臓器がよく描出されている。aはcのーで示す場所の冠状断であり,穿刺のプランニングに適している。bは3Dボディーマークで,スキャン面の三次元的な位置がわかる。
3.US-US Fusion Imaging
さらに,待望の技術であったUS-US Fusion Imagingが可能となった。プローブに取り付けた磁気センサの情報を用いて通常のプローブで高精細3D画像を構築する“Smart Sensor 3D”により,リアルタイムのボリュームデータを取得し,レジストレーションをしておくことで,過去の3Dデータの同じ断面を同期して表示することが可能となる(図2)。
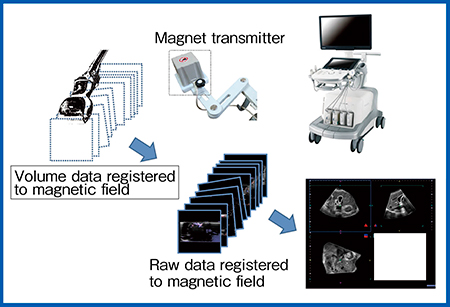
図2 Smart Sensor 3D
磁気センサの付いたプローブを用手的にスキャンして,超音波の3Dデータを取得する。そのraw dataを参照として,リアルタイムの超音波とフュージョンイメージングを行う。
図3 aはRFA施行前のKupffer imageで,腫瘍が陰影欠損として明瞭に描出されている。この画像を参照しRFAを施行するに当たり,同じ断面のリアルタイムの画像(図3 b)を観察することで,治療が正確に行われ十分なマージンが得られていることが確認できる。
このように,RFA施行直前に撮像したBモードや造影モードの3Dデータを施術時に参照可能となることで,従来,局所治療において術前のCTやMRIの画像と超音波画像のFusionが可能な症例は全体の2割程度であったが,US-US Fusionではほぼ100%の症例が適応となるため,メリットが大きい。
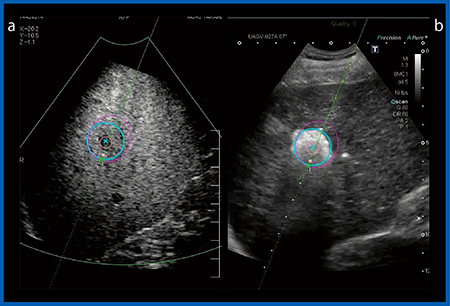
図3 US-US Fusion Imaging
aは治療前にSmart Sensor 3Dで取得したソナゾイド造影のKupffer細胞相の3Dデータ。bはリアルタイムのBモードで,RFA治療中のモニター画像。小さいHCCがaのKupffer細胞相でよく描出されている。腫瘍がピンク色の球でマーキングされ,腫瘍中心部が×印でマーキングされている。同じ断層面のため,RFAのガス像がHCCを十分なマージンを取って治療されていることがわかる。緑色の球が針に付けた磁気センサによって示される針先位置を示す。水色の球が目的とする焼灼域を示し,紫色の楕円球は,Cool-tipの先端(緑色)を針先とした場合の想定焼灼域を仮想している。
Dispersion(粘性)Imaging(W.I.P.)
1.Dispersion Imagingの原理
Shear Wave Elastographyは剪断波が伝播する様子を可視化しており,伝播速度によって組織の“硬さ”を定量することができる。その場合に通常使用されるのは弾性を表すkPaで,硬さ(kPa)=3・p・Cs2で求められる。剪断波の伝播速度〔Cs2(m/s)〕は,一般によく使用されるVoigt modelではμ1〔弾性(elasticity):kPa〕とμ2〔粘性(viscosity):Pa・s〕の値によって決まるが(図4),通常μ2は0と仮定することで,伝播速度から弾性率(ヤング率)が求められてきた。つまり,肝臓においては線維化の程度(弾性)によって伝播速度が決まると考えられてきた。
しかし,その後,B型急性肝炎にて,肝組織の壊死・炎症がピークの時に伝播速度が上昇し,それらが沈静化し線維化が進む回復期に伝播速度が低下することが報告され1),従来の仮定と合わないことから,肝組織の壊死・炎症による粘性の増加が伝播速度に強く影響していることがわかってきた。つまり,剪断波の伝播速度は,組織の弾性と粘性の両方の因子によって決まることが明らかとなった。
粘性がまったくない場合は剪断波の周波数を変えても伝播速度は変わらないが,粘性が増加すると伝播速度は剪断波の周波数に依存して速くなる。そのため,剪断波の周波数と伝播速度の関係をグラフにした場合の傾きを求めれば粘性を求めることが可能である。傾き=Dispersion(m/s/kHz)∝粘性(Pa・s)となり,この傾きは粘性に比例する。超音波のプッシュパルスで生じる剪断波の周波数は200〜800Hzの帯域を持つため,剪断波を周波数解析することでDispersionを求められると考えられている。
2013年には,Chenらが開発した測定器により,肝臓のelasticity(弾性)とviscosity(粘性)を分けて測定できることが報告された2)。本報告では,慢性肝炎が進行すると粘性と弾性が共に増加し,さらに進行して肝硬変になると線維化が進行して弾性が増加するとしている。また,急性肝炎では,壊死・炎症によって粘性が大きく増加することがわかってきた。これ以降,世界中でこのDispersionを測定する装置の開発競争が始まったが,技術的にきわめて困難であり,なかなか実現に至らなかった。

図4 Voigt modelの式
剪断波の伝播速度は弾性と粘性で決まる。
2.Dispersion Imagingの特長
こうした状況の中,東芝メディカルシステムズ社が世界に先駆けてDispersion Imagingを開発した。粘性が大きいと剪断波の波形が変わるが,周波数の高い成分は速く伝わり,周波数の低い成分は遅く伝わるため波形が歪む。それをフーリエ解析することにより,周波数依存の速度変化を求める手法である。しかも,小さいROIで計測するのではなく,2D-Shear Wave Elastographyとして2Dのカラーマッピングとして表示し,かつ定量ができる点は特筆に値する(図5)。
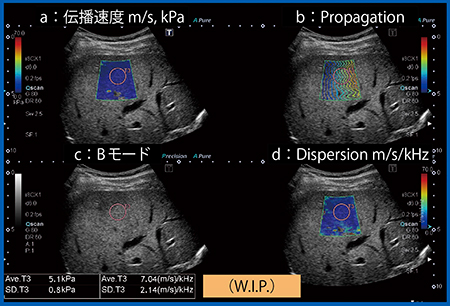
図5 Dispersion Imaging
Dispersion Imagingは4画面表示であり,aが伝播速度(粘弾性),dがDispersionモードである。この正常肝の伝播速度は1.3m/s(5.1kPa)で,Dispersionは7.0m/s/kHzであり,共に正常範囲内にある。
3.Dispersion Imagingの精度検証
1)ファントムを用いた検証(図6)
寒天のみの弾性ファントムと,そこに粘性のある素材を加えた粘弾性ファントムの2つを測定したところ,いずれも弾性(kPa)はほぼ同じであるが,Dispersion(m/s/kHz)は粘弾性ファントムの方が高いことが画像化された(図6 b 右下)。
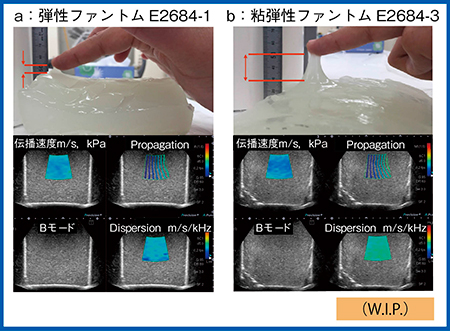
図6 弾性ファントム(a)と粘弾性ファントム(b)のDispersion Imaging
2)動物実験による検証
続いて,東京医科大学にて,ラットに四塩化炭素(CCI4)を腹腔内投与し,急性肝炎モデル(コントロール,2日間および4日間投与モデル)と肝硬変モデル(6週間投与モデル)を作成し,粘弾性とDispersionを測定した。その結果,Dispersionはコントロールと比較し,急性肝炎モデルでは増加しているが,肝硬変モデルでは軽度上昇にとどまった。一方,粘弾性は,肝炎モデルの軽度上昇に対し,肝硬変モデルでは大きく上昇しており(図7),壊死・炎症が粘性を増加し,線維化が弾性を増加するという仮説が証明されたと言える。
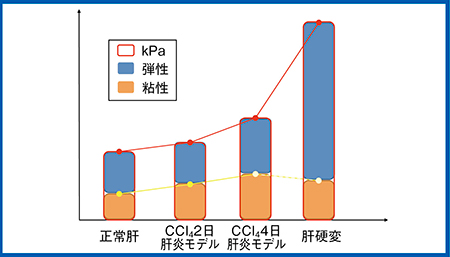
図7 ラット急性肝炎モデルと肝硬変モデルを使った動物実験のデータ
3)臨床例での検討
正常肝の粘弾性:5.0kPa,Dispersion:7.3m/s/kHzに対し,脂肪肝(図8)では粘弾性は6.0kPa(1.4m/s)とわずかに増加,Dispersionは15.28m/s/kHzと著増した。慢性肝炎(図9)では粘弾性が7.3kPa(1.6m/s),Dispersionは15m/s/kHzと増加し,肝硬変では粘弾性が22.7kPa,Dispersionは32.6m/s/kHzといずれも著増した。症例数が少ないため,さらなる検証が必要であるが,脂肪肝や慢性肝炎では粘性が増加し,肝硬変では弾性が著増したと考えられる(図10)。つまり,脂肪肝や慢性肝炎では粘性の増加が,肝硬変では弾性の増加が,それぞれ伝播速度に関与していることが示唆された。
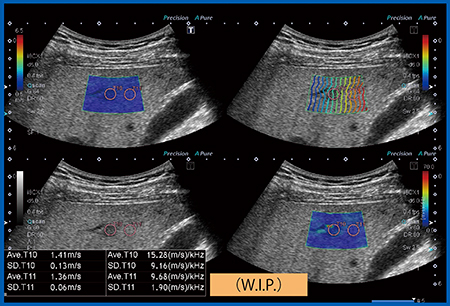
図8 脂肪肝のDispersion Imaging
伝播速度(粘弾性)は1.4m/s(6.0kPa)でほぼ正常なのに対し,Dispersionは10〜15m/s/kHzと上昇している。
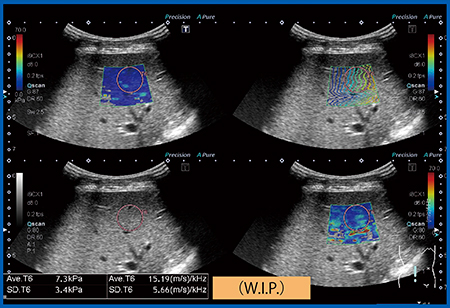
図9 慢性肝炎のDispersion Imaging
伝播速度(粘弾性)は1.6m/s(7.3kPa),Dispersionは15m/s/kHzと,共に軽度上昇している。
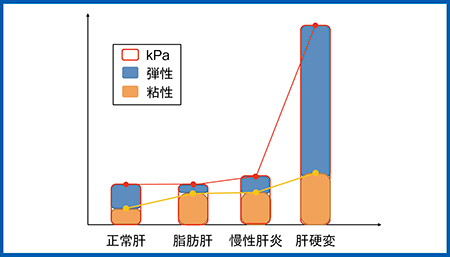
図10 臨床例の弾性と粘性のデータ
さらに,得られた臨床データを,縦軸をDispersion,横軸を粘弾性(伝播速度)としてグラフ化すると(図11),前述のChenらの報告2)と同様に,肝硬変ではある一定の粘性は増加するが,壊死・炎症が沈静化して線維化が進行すると弾性が著増するため,粘弾性の値が高くなった。一方,慢性肝炎や脂肪肝では粘弾性は正常肝と重なってしまうが,Dispersionでは分離される。
病理では,慢性肝炎の生検結果について,炎症の程度(A)と線維化の程度(F)という2つの観点から診断結果を出すが,Shear Wave Elastographyでも臨床現場において同様の観点からの測定あるいはマッピングが可能になったと言える。
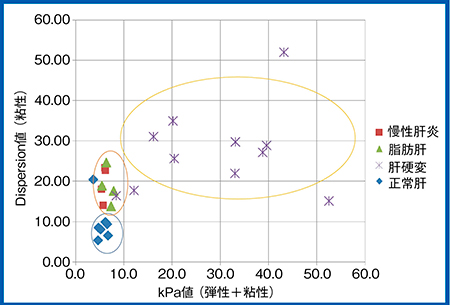
図11 臨床例のDispersion Imagingの測定結果
横軸にkPa表示の粘弾性(伝播速度),縦軸にDispersionで,各疾患の分布を見たもの。
4.Dispersion Imagingの技術的背景
東芝メディカルシステムズ社がDispersion Imagingを実現した背景として,Aplio iシリーズ専用のiDMSプローブが挙げられる。従来は,レンズ方向の焦点は音響レンズによる固定焦点があったが,iDMSプローブでは,“iBeam Slicing”という最新のマトリックスアレイ独立制御技術により精密にスライス厚を制御可能となった。また,焦点が可変となったことで,深さに応じてレンズ方向のフォーカシングが可能となった。加えて,“Multiplexing”によりさらなる高速信号処理を行うことで,三次元ビームフォーミングを可能にしたことも挙げられる。
まとめ
Dispersionを定量し,2Dマッピングすることで,組織の粘性の変化を評価することが可能となった。同時に,剪断波の伝播速度によって組織の粘弾性が測定可能となり,Dispersionとの差分から組織の弾性の変化を評価できるようになった。実臨床において粘性と弾性の両方を1台の超音波診断装置で測定可能になったということである。臨床家が待ち望んでいた本技術を市販機で実現できたのは,世界で初めてのことである。国内メーカーが世界に先駆けてこうした技術を開発したことは,非常に誇らしく,喜ばしいことであり,Aplio iシリーズは世界最高峰の機種と言える。
●参考文献
1)Viganò, M., et al., Eur. J. Gastroenterol. Hepatol., 22・2, 180〜184, 2010.
2)Chen, S., et al., Radiology, 266・3, 964〜970, 2013.

森安 史典(Moriyasu Fuminori)
1975年 京都大学医学部卒業。同年 倉敷中央病院内科。79年天理よろず相談所病院消化器内科。83年 京都大学医学部附属病院。86年 同第一内科助手。87年 エール大学留学を経て96年同消化器内科助教授。2000年〜東京医科大学消化器内科主任教授。2016年〜国際医療福祉大学教授/医療法人財団順和会 山王病院がん局所療法センターセンター長。東京医科大学名誉教授。
- 【関連コンテンツ】
