セミナーレポート(キヤノンメディカルシステムズ)
第77回日本医学放射線学会総会が2018年4月12日(木)〜15日(日)の4日間,パシフィコ横浜(神奈川県横浜市)で開催された。13日(金)に行われたキヤノンメディカルシステムズ株式会社共催ランチョンセミナー2では,名古屋大学大学院医学系研究科総合医学専攻高次医用科学講座量子医学分野教授の長縄慎二氏が司会を務め,自治医科大学附属さいたま医療センター放射線科講師の濱本耕平氏と熊本大学医学部附属病院中央放射線部准教授の北島美香氏が,「キヤノンMRIの新しい幕開け」をテーマに講演を行った。
2018年7月号
第77回日本医学放射線学会総会ランチョンセミナー2 キヤノンMRIの新しい幕開け
Deep Learning ReconstructionのMRI画像診断にあたえるインパクト
北島 美香(熊本大学医学部附属病院中央放射線部)
当院では2018年3月,キヤノンメディカルシステムズ社製の次世代高分解能3T MRI「Vantage Galan ZGO」を導入し,人工知能技術の一つである深層学習(deep learning)を用いたノイズ除去再構成技術“Deep Learning Reconstruction(DLR)”(W.I.P.)について,同社との共同研究を開始した。本講演では,Vantage Galan ZGOの特長を踏まえ,DLRの初期使用経験と有用性について報告する。
Vantage Galan ZGOの特長
Vantage Galan ZGOは,最大傾斜磁場強度(Gmax)が100mT/mを実現するなど,装置全体の性能が従来の3T装置よりも大きく向上している。特に,Gmaxが大幅に向上したことで,高分解能画像の画質改善が期待される。脳神経領域で多用される拡散強調画像(DWI)では,TEを短縮することによりSNR低下を防ぐことができる。実際には,MPG印加時間の短縮によりTEを短縮することができるが,その際,Gmaxが大きく高スリューレートであるほど,MPG印加時間をより大幅に短縮でき,SNRの保たれたDWIの取得が可能となる。
ただし,どこまでTEを短縮できるかは今後の検討課題である。例えば,一般的に使用されるTE 90msからTE 50msまで段階的に短縮していくと,SNRは向上するものの,T2 shine-throughの影響が少なくなり,従来のDWIとはやや異なるコントラストになる。また,b値によってもコントラストが変化し,b=3000s/mm2以上では白質と灰白質のコントラストがきわめて明瞭となる。ただし,b=5000s/mm2以上となるような高b値DWIの臨床的有用性は,今後検討が必要である。
高分解能MRIや高b値DWIは,微小病変の描出能向上や画像情報の増加という利点がある一方,撮像時間の延長とSNRの低下という課題も存在する。これらの解決策として,parallel imaging,multiband,compressed sensingなどによる撮像時間の短縮や,高磁場MRIによるSNRの向上があるが,SNRを向上するもう一つの技術としてノイズ除去が挙げられる。
DLRの特長
1.画質の向上
DLRは,deep learningを利用し,raw data上でノイズ除去を行う新技術で,低SNRの入力画像と高SNRの教師画像から畳み込みニューラルネットワーク(convolutional neural network:CNN)を構築し,これをほかの画像に適用することで教師画像のようなノイズの少ない画像を得ることができる(図1)。一般的なフィルタ処理を用いたノイズ除去の場合,サブトラクション処理後の画像にはノイズだけでなく脳の辺縁や信号の変化した部分が残存するが,DLRではノイズだけを分離でき,実質の信号値やコントラストを担保できる。
図2は,1024×1024マトリックス,3mmスライス厚の高分解能なPD STIR画像である。低SNRの画像に10回加算(NAQ 10)を行うとSNRが向上するが,撮像時間は約17分である(図2左)。
一方,DLR処理を行うと,1分45秒で10回加算の画像と同等の画質が得られる(図2右)。
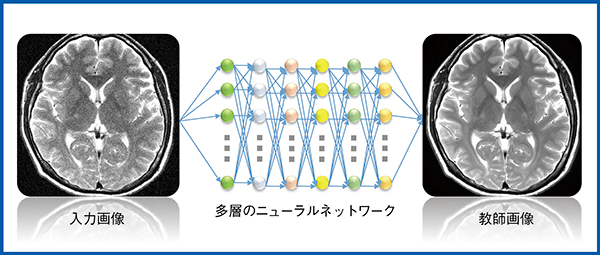
図1 DLRの概念
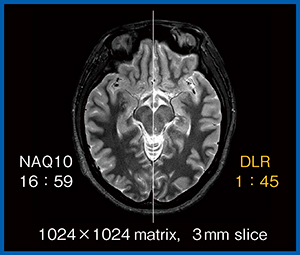
図2 高分解能PD STIR画像における10回加算とDLRの比較
2.DWIへの応用
DLRのもう一つの特長として,すべての撮像シーケンスに適用可能なことが挙げられる。
図3は,1.8mm iso voxelの高分解能whole brain DWIであるが,DLR処理によって画質が改善し,微小な小脳梗塞(↓)も明瞭に描出されている。ただし,DLRの強度を上げすぎると画像の不自然さが目立ってくるため,適切な強度設定が必要である。
また,オリジナル画像とDLR画像の比較では,DLRではノイズが除去されているため,SDがきわめて低値であった。
高分解能whole brain DTIカラーマップでは,DLR処理によってノイズが除去されたことで,髄枝の描出や構造の分離が明瞭となる。また,高分解能DWIから作成したトラクトグラフィは,DLR処理によって神経線維が明瞭となり,オリジナル画像では不明瞭だった視索(↓)も良好に描出されている(図4)。
さらに,近年,複数のb値を用いて脳の拡散を非ガウス分布で評価するための,q-space imaging(QSI)やkurtosis,neurite orientation dispersion and density imaging(NODDI)といった,いわゆるmulti shell DWIの研究が進んでいるが1),このような先進的な画像解析や定量解析においても,DLRの有用性が期待される。
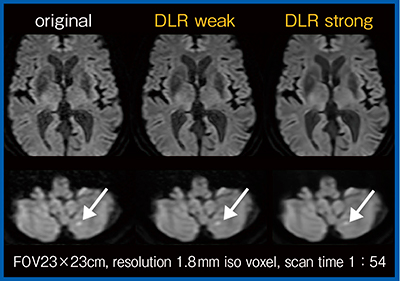
図3 1.8mm iso voxel高分解能whole brain DWIにおけるDLRの効果
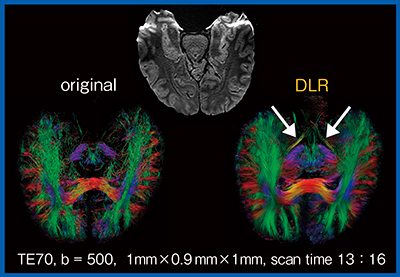
図4 拡散テンソルトラクトグラフィにおけるDLRの効果
3.定量解析における有用性
近年,高分解能3D-T1強調画像から脳皮質の厚さや体積を測定し,認知症や精神疾患の評価を行う研究手法が多く見られる。このような画像解析では,画像分解能が高く,かつノイズの少ない画像を用いることにより,測定精度が高くなると考えられる。7T MRIでスライス厚1mmと0.5mmを比較したところ,0.5mmではパーシャルボリューム効果の影響が低減し,皮質の厚さが1/3〜1/6になるという報告もある2)。今回,0.8mm iso voxelのMPRAGE画像(図5)を用いて検討したところ,オリジナル画像と比較してDLR画像では前頭葉の画像解析エラーが低減した。このように,DLRは定量解析研究にも寄与すると思われる。
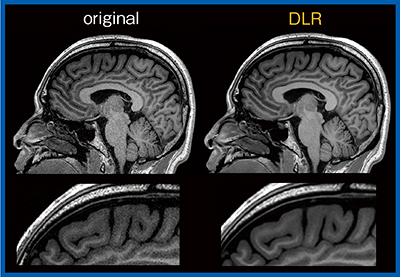
図5 0.8mm iso voxel MPRAGE画像におけるノイズの低減
4.海馬領域の高分解能T2強調画像におけるDLRの検討
DLRは2Dの撮像にも応用可能である。図6は,FOVを絞って約3分で撮像した海馬の高分解能T2強調画像であるが,DLRを適用することでノイズが大幅に低減し,海馬の内部構造なども明瞭に描出されている。
そこで,われわれは海馬のT2強調冠状断像を用いてDLRの検討を行った3)。定量評価では,高分解能T2強調画像と,加算回数の少ない画像,および少ない加算回数でDLRを適用した画像を比較したところ,DLRの画像では灰白質,白質,被殻,脳脊髄液のいずれにおいてもノイズが大幅に低減していた。視覚評価でも,DLRを適用した方が全体的に画質は良好であった。ただし,白質と被殻の境界や,海馬内の帯状の低信号は,DLRの強度が強すぎるとかえって不明瞭となることがわかった。また,オリジナル画像のコントラストが保持されていない場合は,DLRを適用しても病変や海馬内の微細構造物などの描出能は向上しなかった。さらに,ノイズを低減することでフローアーチファクトが目立つ場合も見られた。フローアーチファクトの低減には,3D-T2強調画像へのDLRの適用が有用かもしれない(図7:0.3mm iso voxel)。
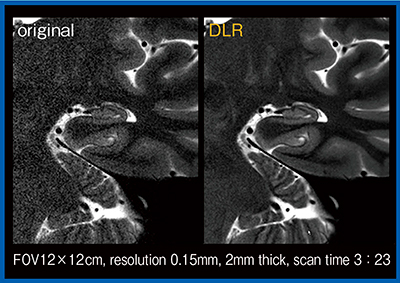
図6 海馬の高分解能2D-T2強調画像におけるノイズ低減
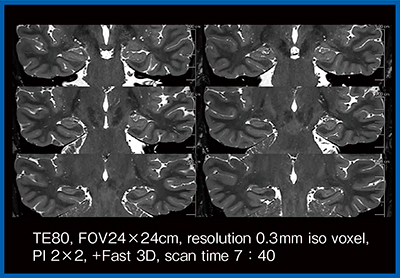
図7 0.3mm iso voxel 3D-T2強調画像におけるフローアーチファクトの低減
5.その他のシーケンスへの応用
このほか,脳神経領域でよく用いられる3D撮像に,FLAIRやdouble inversion recovery(DIR)がある。3D-DIRは,皮質の梗塞や皮質近傍の多発性硬化症(MS)のプラークの検出に有用であるが,SNRが低い。しかし,DLRによるノイズ低減を用いることにより,高分解能3D-DIRでもSNRの保持された画像を得ることができる(図8)。
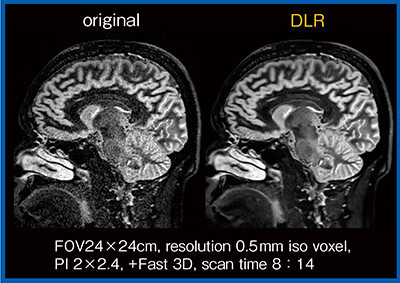
図8 MS症例の1.4mm iso voxel 3D-DIR画像におけるDLRの効果
まとめ
DLRは,さまざまなシーケンスに適用可能であり,MRIの画質向上や撮像時間の短縮が期待される。また,DLRは,ルーチン画像のみでなく,高分解能画像の画質向上や定量解析への寄与も期待される。
●参考文献
1)Zhang, H., et al., Neuroimage, 61・4, 1000〜1016, 2012.
2)Lusenbrink, F., et al., Neuroimage, 70, 122〜131, 2013.
3)Kidoh, M., Kitajima, M., et al.(in submission).

北島 美香(Kitajima Mika)
1990年 熊本大学医学部放射線科入局。1998年同助手,2007年同講師を経て,2010年より熊本大学医学部附属病院中央放射線部准教授。
- 【関連コンテンツ】
