セミナーレポート(キヤノンメディカルシステムズ)
2018年4月26日(木)〜28日(土)の3日間,一般社団法人日本心エコー図学会第29回学術集会がいわて県民情報交流センター「アイーナ」(岩手県盛岡市)で開催された。27日に行われたキヤノンメディカルシステムズ株式会社共催のランチョンセミナー5では,大阪大学大学院医学系研究科保健学専攻機能診断科学講座教授の中谷 敏氏が座長を務め,岡山大学循環器内科超音波診断センターの高谷陽一氏と長野県立こども病院循環器小児科の瀧聞浄宏氏が,「心エコーで考える最新の治療戦略」をテーマに講演を行った。
2018年8月号
一般社団法人日本心エコー図学会第29回学術集会ランチョンセミナー5 心エコーで考える最新の治療戦略
Fusionイメージング
高谷 陽一(岡山大学循環器内科 超音波診断センター)
本講演では,心臓領域のFusionイメージングについて,キヤノンメディカルシステムズの超音波診断装置「Aplio i900」に搭載された“Smart Fusion”技術による成人先天性心疾患(Adult Congenital Heart Disease:ACHD)診断の有用性と,“US Cardiac Fusion”を用いた冠動脈疾患の心筋虚血評価について報告する。
Smart Fusionの概要
Aplio i 900のSmart Fusionでは,CTやMRI画像を装置に取り込むことでサイドバイサイドで画像を表示し,断面を連動してリアルタイムに評価できる。プローブに取り付けた磁気センサで位置や角度を検出するため,プローブの操作と画像の追従性も高く,ストレスなく操作が行える。
成人先天性心疾患(ACHD)
ACHDは,治療法の進化によって年間1万人前後増加しており,循環器内科で扱う患者数や疾患の種類も増えている。当院では従来から心房中隔欠損症(ASD)に対するカテーテル治療を年間100件前後手掛けているが,さらに複雑で重症度の高い先天性疾患の症例も,年間60件程度と増加傾向にある。
ACHDは,複雑な心臓形態を持ち,手術など治療を繰り返していることからエコーウィンドウが制限され,超音波による病態の把握が難しい。これにCTやMRIのデータを利用したFusionイメージングを適用することで,形態把握が容易になり,さらに超音波のリアルタイム性や動的評価が行えることでACHDに有用だと考えられる1)。
1.症例提示
症例1は,42歳,二次孔型のASDである。ASDのカテーテル治療では,欠損部分のサイズを正確に把握した上で適切なデバイスを選択することが重要である。Smart Fusion(図1)では,CTをリファレンスとしてエコーで欠損孔がクリアに確認でき,カラードプラによってフローも確認できる。経食道ではなく経胸壁エコーで最大径を確認できる可能性がある。
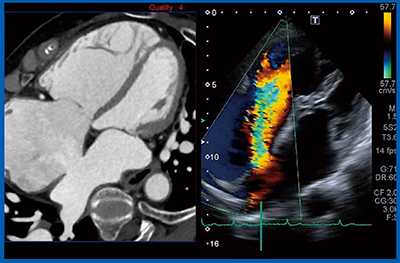
図1 症例1:42歳,二次孔型心房中隔欠損症
症例2は,34歳,総動脈幹症の症例である。総動脈幹症は,遺残した総動脈幹が肺動脈(PA)と大動脈(Ao)に分岐する様態を示し,Van Praagh分類で血管の分岐などの形状によって4つのタイプに分類される。超音波画像では総動脈幹からPAが起始した後,左右に分岐するタイプA1と考えられた(図2)。しかし,これをSmart Fusionにて確認したところ,左のPAはAoから分岐したタイプA3だということがわかった(図3)。超音波では評価が難しい断面であっても,Smart Fusionを使うことでCTの形態情報に基づいた病変部の確認と,超音波のドプラによる血流情報を組み合わせて,より精度の高い評価が可能になる。Smart Fusionでは,心エコー図の評価をグレードアップし,より確実で詳細な検査を行うことができる。
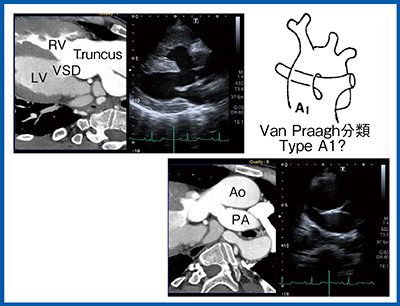
図2 症例2:34歳,総動脈幹症
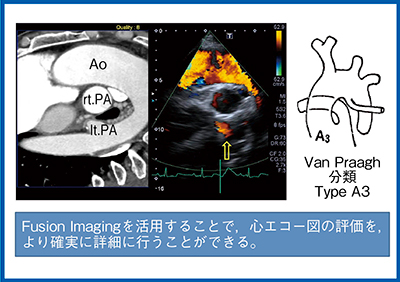
図3 症例2のSmart Fusion
2.Smart Fusionのアドバンテージ
Smart Fusionは,「CT画像を参照しながら超音波を見ているだけでは?」「CT画像が重要で超音波画像は必要ないのではないか」といった意見がある。ACHDに対して超音波検査をする際には,検査前に電子カルテ上でCT画像を確認し,頭の中で三次元化して形態を把握してから手技に向かう。そして,検査後に疑問点や不明点を再びCT画像に戻って確認することが多い。
Smart Fusionでは,あらかじめCTデータを超音波診断装置内に内蔵できるため,プローブの動きに合わせてリアルタイムでCT画像を動かすことができる。CT画像を参照することで,断面や輪郭の設定の精度が向上し,ドプラによる計測の再現性も高くなる。超音波による狭窄や血行動態の評価が正確に行えることもメリットとなる。以下に,Smart Fusionが有効であった症例を紹介する。
3.Smart Fusionによる症例提示
症例3は,62歳,心室中隔欠損症(VSD)術後,大動脈弁置換術後で,労作時呼吸困難と聴診による連続性雑音にて受診した。超音波検査では,paravalvular leakとVSD Residual shuntがあり,さらにValsalva洞に連続性の血流が認められた。Valsalva洞破裂を疑い,直前に撮影したCTとのSmart Fusionを行った(図4)。CTでValsalva洞から右室へ交通を認め,超音波で同部位にshunt flowが明瞭に確認できた。さらに,パルスドプラにより連続性flowが認められたことからValsalva洞破裂と診断できた。
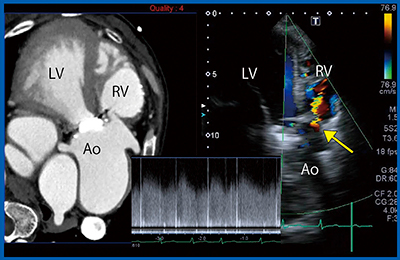
図4 症例3:62歳,VSD術後 大動脈弁置換術後,Smart Fusion
症例4は,40歳,修正大血管転位Rastelli術後で倦怠感と収縮期雑音で受診。超音波では,肺動脈に狭窄が認められ,最大血流速度は3.5m/sだったが計測箇所が不明確で,超音波だけでは病態の正確な把握が困難だった。CTとのSmart Fusionを行ったところ,CT画像で狭窄部位はRastelli管内であることがわかった(図5)。同部位で血流を評価したところ,最大血流速度は4.5m/sであり,病変部位と重症度の診断に有用であった。
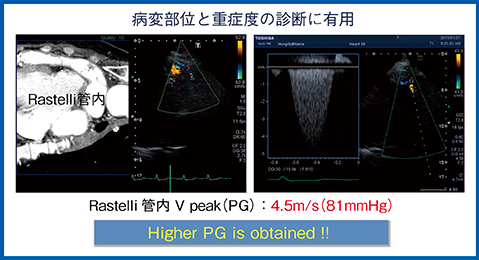
図5 症例4:40歳,修正大血管転位 Rastelli術後,Smart Fusion
※ ※
ACHDにおけるSmart Fusionのメリットは,CTやMRIの画像をプローブに連動して自由自在に切り出し,心臓の形態をサイドバイサイドで画像を確認しながら超音波画像で評価できることである。また,超音波での所見を,CT/MRI画像を基に見直して瞬時に確信することができ,より確実に詳細な診断が可能になる。さらに,超音波で画質の描出が不十分であっても正確な血行動態の評価が得られることもメリットである。
冠動脈疾患に対するFusionイメージング
われわれは,冠動脈疾患に対するFusionイメージングの有用性についても検討を行っている。経皮的冠動脈形成術(PCI)には,施行前に虚血評価が必須である。冠動脈の狭窄の評価にはCAGや心臓CTが,虚血の評価方法としては心筋SPECTやFFRなどがある。FFRは侵襲的であり,SPECTはコストが高く実施施設が限られるなどの課題がある。非侵襲的に低コストで実施可能な方法として超音波のFusionイメージングの活用について検討を行った。
1.US Cardiac Fusion
われわれは,キヤノンメディカルシステムズの画像解析ワークステーション「Vitrea」を利用して,超音波の3D壁運動解析アプリケーション“3D-Wall Motion Tracking(3D-WMT)”による壁運動情報と,冠動脈CTの情報をフュージョンするUS Cardiac Fusionで評価を行った。3D-WMTは,スペックルトラッキング技術を用いた心筋壁運動解析アプリケーションであり,2Dとは異なり三次元的に心臓を評価できることから,断面依存性がなく“through-plane”を克服することができる。さらに,病変の範囲をイメージしやすいことがメリットである。
スペックルトラッキングによる虚血の評価については,さまざまな議論がある。スペックルトラッキングでの虚血評価の指標としては,post-systolic shortening(PSS)の有無,ストレインの低下,area change ratio(ACR)の低下などが報告されている。どの指標にも一長一短があり,例えばPSSでは陽性であっても心筋虚血に特異的ではなく超音波だけでは判断しにくい。また,胸痛の前後でPSSの変化があった場合に虚血と判断できるが,胸痛前に超音波検査が施行されている例は少ない。
そこでわれわれは,PSSが冠動脈支配領域に一致すれば虚血の可能性が高いとの報告があることから,冠動脈と超音波による心筋虚血の状態がイメージしやすい表示方法であれば診断の可能性が高まると考えた。US Cardiac Fusionを用いてCTによる冠動脈の形態と超音波をフュージョンすることで,“どの血管が責任病変なのか(LAD or LCX or RCA)”“どの部位から虚血を呈しているのか(proximal or mid)”などの評価が可能になると考えられる。US Cardiac Fusionでは,3D-WMTとCTデータをVitreaに取り込むが,CTと超音波双方で左室の長軸および短軸を算出し,それらを自動位置合わせすることでワンタッチでFusionイメージングが得られる。
2.症例提示
US Cardiac Fusionを用いた症例を供覧する。症例5は,69歳,女性,心電図で陳旧性心筋梗塞(OMI)を疑われ受診した。心臓CTでは,RCAは♯1で完全閉塞(CTO),LCXはmidに狭窄が疑われた(図6)。CAGも同様の所見で,超音波の4D画像では下壁に動きの悪い部分が認められた(図7)。この症例でAplio i900でスペックルトラッキングを行った。
今回,壁運動を解析する指標として,“Dyssynchrony Imaging-Post Systolic shortening(DI-PSS)”を採用した。長軸方向の変位がpeakに達するまでの時間に比べて,PSSのpeakの遅延が心筋の虚血を反映すると考えられている。Tissue Doppler Imaging(TDI)を用いた安静時の拡張期異常の検討でも,peakの遅延と虚血との関連が報告されている2),3)。これを基にスペックルトラッキングで,PSSの遅延が大きいほど赤→黄色→緑で表示した。
DI-PSSによる3D-WMT(図8)では,polar mapとtime curve analysis(TCA)で心筋のPSSを可視化できる。CTデータとフュージョンしたUS Cardiac Fusion(図9)では,polar mapでRCAのCTOに対応した領域に赤い虚血領域が認められ,LADには虚血がないことがわかる。また,LCXについても狭窄が疑われた領域に対応して虚血が認められた。
US Cardiac Fusionでは,CTと心エコーの3D-WMTをフュージョンさせることで,虚血領域と責任病変を判断できる可能性が示された。SPECTやFFRでは,多枝病変や高度石灰化症例では評価が難しいこともあり,超音波による心筋虚血の評価への期待は大きい。
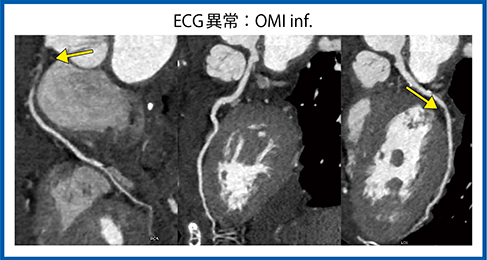
図6 症例5:心電図異常,陳旧性心筋梗塞疑い,心臓CT
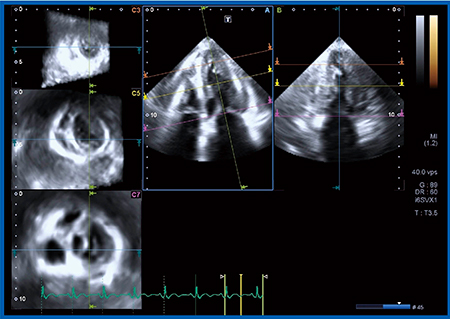
図7 症例5の超音波4D画像
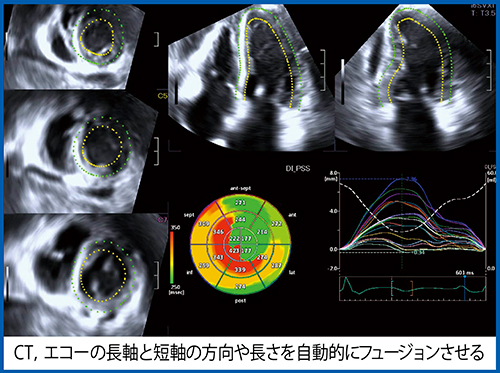
図8 症例5の3D-WMT,DI-PSS
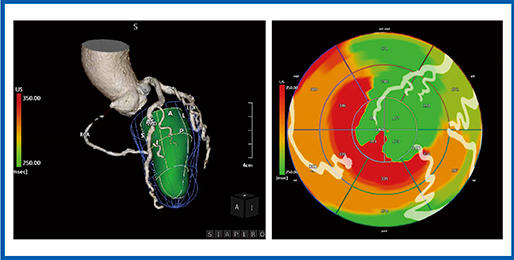
図9 症例5のUS Cardiac Fusion
3.今後の課題
今後の課題として,US Cardiac Fusionで冠動脈疾患の虚血評価の可能性について検討を重ねていくことが必要となる。今後,3D-WMTの画像精度の向上,心筋虚血評価の指標の検討,重症虚血だけなく中等度の虚血に対しても薬物や運動負荷との組み合わせで評価していくことが必要となる。
まとめ
CTやMRIと超音波の画像を用いたFusionイメージングは,外科医やIVR医など多領域での治療が必要となるACHDで,超音波での評価を明確に表示できる有用性がある。また,冠動脈疾患においてもCTとのフュージョンによって心筋虚血の評価の可能性が期待される。
●参考文献
1)Oe, H., et al., J. Cardiol., 2018(Epub ahead of print).
2)Onishi, T., et al., Circ. J., 73・1, 125~131, 2009.
3)Onishi, T., et al., J. Am. Soc. Echocardiogr., 23・10, 1103~1108, 2010.

高谷 陽一(Takaya Yoichi)
2004年 岡山大学医学部卒業。
2012年より現職。ASDなどStructure heart diseaseのカテーテル治療に携わりながら超音波画像診断を行う。
- 【関連コンテンツ】
