セミナーレポート(キヤノンメディカルシステムズ)
2018年4月26日(木)〜28日(土)の3日間,一般社団法人日本心エコー図学会第29回学術集会がいわて県民情報交流センター「アイーナ」(岩手県盛岡市)で開催された。27日に行われたキヤノンメディカルシステムズ株式会社共催のランチョンセミナー5では,大阪大学大学院医学系研究科保健学専攻機能診断科学講座教授の中谷 敏氏が座長を務め,岡山大学循環器内科超音波診断センターの高谷陽一氏と長野県立こども病院循環器小児科の瀧聞浄宏氏が,「心エコーで考える最新の治療戦略」をテーマに講演を行った。
2018年8月号
一般社団法人日本心エコー図学会第29回学術集会ランチョンセミナー5 心エコーで考える最新の治療戦略
小児重症心不全治療におけるCRT on site imaging ─“スイートスポット”へのリード留置の重要性
瀧聞 浄宏(長野県立こども病院循環器小児科)
心臓再同期療法(cardiac resynchronization therapy:CRT)は,成人の心不全症例はもちろんのこと,小児の拡張型心筋症(dilated cardiomyopathy:DCM)や先天性心疾患(congenital heart disease:CHD)の心不全例でも有用である。本講演では,当院における小児重症心不全症例に対するCRTを紹介した上で,キヤノンメディカルシステムズ社の超音波診断装置で使用できるアプリケーション“Activation Imaging(AI)”と“Smart Fusion”の臨床的有用性について述べる。
CRTにおける術中の至適ペーシングサイト検証の重要性
CRTの適応については左室収縮の非同期(dyssynchrony)で評価するが,Mモード法,組織ドプラ法,パルスドプラ法などの従来の心エコー法,さらにスペックルトラッキング法でも患者選択が難しいとされているのが現状である。European Society of Cardiology(ESC)のガイドライン1)では,CRT適応のスタンダードな患者選択は,左脚ブロック(LBBB)でQRS幅が130ms以上,左室駆出率(left ventricular ejection fraction:LVEF)が35%以下とされている。また,STARTER study2)では,エコーガイド下にて,心筋ストレインの短軸方向(radial strain:RS)の興奮最遅延部位(latest peak)に左室リードを留置することで,予後が有意に改善すると報告された。しかし,その左室リード留置の至適ペーシングサイト(スイートスポット)については議論されており,実際には電気生理的な左室リードのターゲットエリアは広いと言われている3)。
小児を対象としている当院のCRTでは,任意の部位に留置できる心外膜リードを使用して,至適ペーシングサイトに留置できているかを術中に心エコーで検証している。CRTにおいては,至適ペーシングサイトへのリードの留置と,それが確実に至適ペーシングサイトに留置されているかを術中心エコーで検証して初めて,手術が成功したか否かを判断できると考えている。
当院における小児重症心不全に対するCRT
当院における小児重症心不全症例に対するCRTについて紹介する。対象は,小児DCMとCHD心不全の患者16例で,患者選択は心エコーでdyssynchronyがあることを確認している。CRT時の年齢は中央値11か月(4か月〜22歳),内訳は乳児DCMが9例〔男4例,CRT時年齢:中央値11か月(6か月〜1歳)〕,Fontan & Fontan candidateが7例〔男4例,CRT時年齢:中央値2歳(4か月〜22歳)〕である。
dyssynchronyの評価指標4)は,中隔(septal)と後側壁(posterolateral),もしくは心室間(inter ventricular)のRS peakの時間差(TD-RS)が130ms以上と,septal flash(二段モーション)とshuffle motion(左室心尖部が側方にスウィングする動き)があるかで判断している。一例を示すと,症例1(図1,DCM Case 3)は10か月,女児,LVEF 8%,BNP 5210pg/mLで緊急入院となり,カテコラミン治療でBNP 451pg/mLまで改善した。dyssynchronyの評価指標では,RS peakが最も遅いのは側壁(lateral)と後壁(posterior)あたり,最も早いのが中隔あたりで,TD-RS は約320msである。なお,乳児DCMの9例はすべてTD-RSが200ms以上,septal flashとshuffle motionはともに存在した。
1.乳児DCM
乳児DCMの9例(図1)は,ほとんどが1歳前後(1例のみ3歳),体重は3〜6kg,心不全重症度分類(NYHA)は多くがⅣ,QRS幅130ms以上は5例のみである。心胸郭比(CTR)はおおむね70%,LVEFは多くが10%前後,BNPは19〜2014pg/mLで,カテコラミンを離脱できない症例がほとんどである。
●症例提示
前出の症例1(図1,DCM Case 3)は急性心不全でICU入室となり,カテコラミン治療後,カルベジロールを開始。その後,風邪により状態が悪化したため再度ICU入室し,カテコラミンでLVEFを少し上げてからCRTとなった。CRT時はBNP 750pg/mLである。
CRTのリード留置は,胸骨正中切開と側開胸を行って,実際に心房−心室ペーシングし,リードポジションを変えながら術中に心エコーで観察して至適ペーシングサイトを探す。経胸壁心エコー/経心膜心エコーにてseptal flashとshuffle motionの改善と,心電図のQRS幅を確認しながら,左室の収縮最遅延部位(latest contraction site)を予想した周囲3,4か所を探して,鰐口クリップの電極で刺激を与えて至適ペーシングサイトを確認し,左室リードを装着する。左室流出路(LVOT)のvelocity time integral(VTI)も同時に計測する。次に,右室流出路(RVOT)近辺も同じように,3,4か所を探して右室リードを装着する。
症例1(DCM Case 3)はCRT後,カテコラミン減量,カルベジロール増量し,LVEFが40%弱まで回復して退院となった。4年後の経過観察では,LVEF がICU入室時の8%から59%に,左室収縮末期容量(LVESV)が154mL/m2から27 mL/m2へと劇的に改善した。
CRTを施行した乳児DCMの結果を図2に示す。NYHAは全例でⅠ,BNPも正常化(Case 9は半年後に正常化),LVEFもほぼ正常化している。なかでもLVESVが劇的に改善しており,super-responderの定義をはるかに超えている。Case3,8,9はカテコラミン離脱がほぼできずに,心移植直前となっていた症例である。

図1 乳児拡張型心筋症(DCM)症例
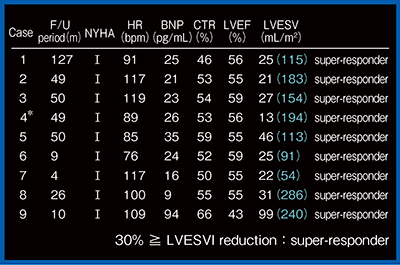
図2 乳児DCMのCRT後の結果
2.Fontan & Fontan candidate
Fontan & Fontan candidateの7例に認められた心室間非同期(inter ventricular dyssynchrony)にも,CRTが非常に有効である。Case 2と7を除く5例で同時手術を行っている。
●症例提示
症例2(Fontan & Fontan candidate Case 6)は2歳8か月,女児で,両大血管右室起始症(DORV),肺動脈弁狭窄症(PS)である。39週2日,2696gで出生,生後1か月時に右ブラロックシャントを施行。心室中隔欠損(VSD)の形態から2心室修復は難しいと判断し,Fontan candidateとなった。そして,1歳3か月時に両方向グレン手術,心房中隔欠損(ASD)拡大,VSD拡大,完全右脚ブロック(CRBBB)となり,QRSの延長,左心機能低下,BNP 140pg/mLで,左室にペースメーカーを留置している。
心エコーでは,右室は正常に動いているものの,右室が収縮するときに左室がseptal flashで奇妙な動きをすることが観察された。心臓カテーテル検査では,肺動脈(PA)圧は比較的良好であったが,左室拡張末期容量(LVEDV)と右室拡張末期容量(RVEDV)の年齢帯のノーマル値(% of normal)を求めたところ,LVEDV ,RVEDVともに219%と心室が非常に拡張していたため,CRTと両大静脈肺動脈吻合(TCPC)でのFontan手術を同時に行うことになった。
シミュレーションにより,左室リードのペーシングサイトは側壁に近い乳頭筋が適していることを外科医と確認し,左室リードを留置した。本症例は,右室リードも留置しなければ動きが良くならなかったため,右室リードのペーシングサイトが決め手となると考え,RVOTの4か所を術中エコーで検証した。
1か所目のペーシングサイトでは,中隔と後壁の動きの異常が少し残り,スペックルトラッキングでは後側の伸展が認められた。前側(anterior)は少し収縮するが,全体的にseptal flashが認められた。
このペーシングサイトから3〜4mm下に位置をずらすと,全体的にRSが向上し,効果が認められたため,このペーシングサイトに右室リードを留置した。心臓全体にROIを設定したスペックルトラッキングでは,全体的に収縮していることが確認でき,心室間非同期の改善も認められた。血圧も,左室ペーシングから両室ペーシングにすることで,50/31(38)mmHgから65/35(44)mmHgへと,15mmHgほど上昇した。外科医からは血圧50mmHgではFontan手術は施行できないと言われていたが,CRTを行ったことで65mmHgまで上昇し,Fontan手術を実施できた。1年後にはQRS,BNPは正常に近くなり,心機能が改善している。
Fontan & Fontan candidate症例の結果を図3に示す。Case 2は,重症の弁逆流で弁形成も同時に行っており,心室間非同期は改善したが亡くなっている。ほかの症例については,NYHA,BNP,面積変化率(FAC)とも改善している。
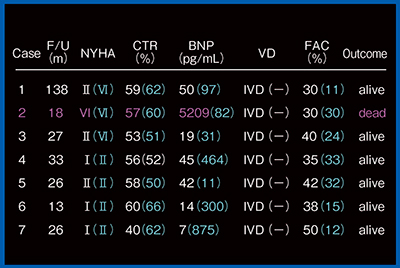
図3 Fontan & Fontan candidateのCRT後の結果
CRTにおけるActivation Imaging(AI)の有用性
キヤノンメディカルシステムズ社の超音波診断装置には,スペックルトラッキング技術を用いた心筋壁運動解析アプリケーション“Wall Motion Tracking”(2D-WMT,3D-WMT)が搭載されている。そして,この3D-WMT技術を用いて,収縮開始時相を画像化する機能がActivation Imaging(AI)である。
われわれは,Activation Imagingで小児の微妙なseptal flashの速い動きをとらえられるかを検討した。Activation Imagingは,最大ストレイン値の25%を収縮開始の至適な閾値として初期設定されており,収縮開始に要した時間をそれぞれ対応するカラーでイメージングする5)。なお,検討ではCRTのONとOFFで比較している。
まず,症例3(DCM Case 6:図1)の2D-WMTを見ると,CRT OFF(図4 a↓)では微妙で速いseptal flashを描出できており,CRT ON(図4 b)にするとseptal flashが消えることが確認できる。これまで,さまざまなベンダーの超音波診断装置で2Dスペックルトラッキングを行ってきたが,このような動きをとらえられる装置は限られている。
Activation Imagingでは,ボリュームレート40vpsまで設定できることがポイントとなるが,高いボリュームレートで撮像してCRT OFF(図5 a)にすると,septal flashの部位が赤色で描出される。そして,CRT ON(図5 b)にすると電極位置が赤色で描出され,発火していることがわかる。小児の心拍数は80〜100bpmほどだが,Activation Imagingでは非常に高い感度で細かい動きをとらえられる可能性がある。
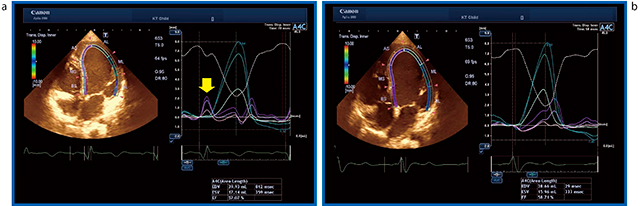
図4 症例3(DCM Case 6)の2D-WMT a:CRT OFF,b:CRT ON
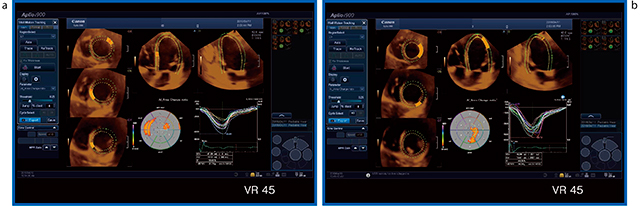
図5 症例3(DCM Case 6)のActivation Imaging a:CRT OFF,b:CRT ON
心内腔評価におけるSmart Fusionの活用
Smart Fusionは,磁気発生ユニットとプローブに取り付けられた磁気センサで位置情報を得て,CT,MRIのボリュームデータと超音波画像の座標を合わせて表示する機能である。
心エコーとCT/MRIの比較については,MRIと心エコーで左室壁の厚さを評価した検討があり,厚さにばらつきがあったことが報告されている6)。そこでわれわれは,心臓壁の中でも特に薄い右室壁を心エコーできちんと観察でき,心内腔を評価できているのか,Smart Fusionを用いて確認した。
症例4は,左心低形成症候群の1歳児で,心エコーとCTで見えている大きな1つの心室は右室である。心エコーでは,右室の自由壁側も中隔側も壁厚が厚く見えるが,CTのリファレンス画像では右室の自由壁は非常に薄く,収縮期には肉柱が寄せ集まって内腔を小さくしている(図6)。したがって,CTに合わせるように心エコーで内腔をトレースすると,思ったよりも外側にトレースしなければならないことがわかる。このようにトレースすると,右室内腔の面積値,FACも合ってくる(図7)。実際,われわれが日常,右室内腔をトレースしている場所は,実は間違っている可能性がある。自由壁側は特に,壁厚をもっと薄くとっていく必要があるかもしれない。
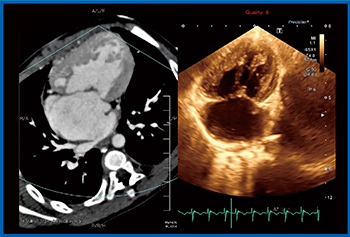
図6 症例4(左心低形成症候群,1歳)の
Smart Fusion(収縮期)
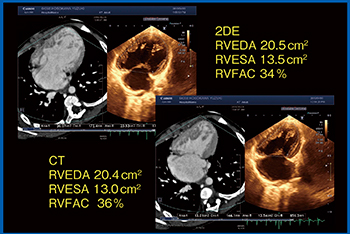
図7 症例4(左心低形成症候群,1歳)の心内腔評価
まとめ
DCMやCHDなど小児重症心不全に対するCRTにおいては,外科医とコラボレーションして,術中心エコーでスイートスポットに心外膜リードを留置することが手術成功のカギである。CRTによる効果を得て,その後の治療で心不全を改善することで,心移植を回避できた症例もある。
そして,Activation Imagingは小児心不全に対するCRTの患者選択,術中心エコーに活用できる可能性がある。また,Smart FusionはCHDの心内腔の正確な評価の一助になると考えている。
●参考文献
1)Ponikowski, P., et al., Eur. Heart J., 37, 2029〜2200, 2016.
2)Saba, S., et al., Circ. Heart Fail., 6, 427〜434, 2013.
3)Khan, F.Z., et al., Europace, 11, 554〜561, 2009.
4)Suffoletto, M.S., et al., Circulation, 113, 960〜968, 2006.
5)Seo, Y., et al., Circ. J., 77, 2481〜2489, 2013.
6)Hindieh, W., et al., Circ. Cardiovasc. Imaging, 10, e006309, 2017.

瀧聞 浄宏(Takigiku Kiyohiro)
1992年 横浜市立大学医学部卒業。神奈川県立こども医療センターのジュニアレジデントを経て横浜市立大学小児科大学院で博士課程を取得。1999年 長野県立こども病院循環器科フェロー,2002年 横浜市立大学医学部小児循環器科助手,2007年より長野県立こども病院循環器小児科部長。
- 【関連コンテンツ】
