セミナーレポート(キヤノンメディカルシステムズ)
2018年6月8日(金),9日(土)の2日間,第37回日本脳神経超音波学会総会が神戸国際会議場・神戸ポートピアホテル(兵庫県神戸市)で開催された。8日に行われたキヤノンメディカルシステムズ株式会社共催のランチョンセミナー2では,岩手医科大学神経内科の寺山靖夫氏が座長を務め,奈良県立医科大学神経内科・脳卒中センターの斎藤こずえ氏と岩手医科大学脳神経外科の小笠原邦昭氏が,「プラーク不安定性評価法のup-to-date」をテーマに講演を行った。
2018年9月号
第37回日本脳神経超音波学会総会ランチョンセミナー2 プラーク不安定性評価法のup-to-date
超音波を用いたプラーク不安定性の新たな評価法
斎藤こずえ(奈良県立医科大学神経内科・脳卒中センター)
本講演では,超音波診断装置の進歩を踏まえ高画質Bモードを駆使したプラークの質的診断の重要性と,造影超音波によるプラーク不安定性の評価について概説する。さらに,キヤノンメディカルシステムズが開発した血流イメージング技術“Superb Micro-vascular Imaging(SMI)”による新たな評価法を解説する。
プラークの質的診断の重要性
図1は,軽度狭窄のある脳梗塞再発例であるが,右麻痺の症状で発症し超音波を施行した。超音波では,カラードプラで低輝度プラークが確認でき,高リスクであると考えられたが,NASCET法では狭窄率が22%と低かった。一方で,MRIでは,TOF-MRA,MPRAGE法共に高信号で描出されており,粥腫内出血などが疑われた。これまで無治療で初発でもあり,さらに狭窄度も低いことから内科治療が選択されたが,造影超音波で多数の新生血管が見られ,高リスクも疑われていた。その後の経過観察では,1年後に軽度の右麻痺で再発しており,カラードプラではプラークのボリュームに変化はなく低輝度で描出されているが,ソナゾイドによる造影超音波(図1左下)では,新たに潰瘍ができているのが観察できた。抗血栓療法を強化するも再発し治療抵抗性と判断し,頸動脈内膜剥離術(CEA)が行われた。その結果,線維性被膜破綻や,新生血管が増生し潰瘍部に血栓が付着していたり,粥腫内出血が見られたりするなど,不安定プラークであることが裏づけられた。このような場合,どの時点でプラークの不安定性を評価し,治療介入を行うかを判断するのは非常に困難であるが,本症例ではソナゾイド造影超音波が有用であった。
キヤノンメディカルシステムズの「Aplio iシリーズ」に搭載された技術“iBeam Forming”は,浅部から深部まで超音波の送受信ビーム形状を細く,高密度にする。また,“iBeam Slicing”では,プローブのスライス厚制御を精密に行い,分解能がさらに向上している。このような技術進歩によって,Bモード画像で得られる情報も変わってきている。
また,技術進歩によって超広帯域の高周波プローブ(iDMSプローブ)が登場しているので,プローブの選択においても,従来のような狭窄の同定(量的評価)から,狭窄部の性状評価(質的評価)へと目的が変わってきた。高周波プローブによって高分解能画像を取得でき,より深部の内頸動脈にあるプラークの性状評価を行えるようになり,1本のプローブで検査が完結するようになった。図2は,17MHzという高周波プローブのBモード画像であるが,プラークの性状が明瞭に描出されている。これまでにも,われわれが行った頸動脈エコーでの線維性被膜の評価では,線維性被膜が高輝度で描出されていた。Bモード画像と病理標本との比較を行ったところ,プラークが破綻している箇所が相関しており,線維性被膜の評価が可能であるという結果が得られている。さらに,従来頸動脈エコーではプラークが低輝度の場合は脳梗塞の発症リスクが高いとされてきたが,プローブの機能向上により,こういったより詳細な内部性状評価が可能になってきたことで,より多くの情報による診断が行えるようになってきている。
Bモードによるプラーク内部の性状の評価では,輝度,内部性状の不均一性,jelly fish sign,線維性被膜破綻(潰瘍)などの情報をリアルタイムで得ることが可能である。例えば,内部性状の不均一性については,音響陰影の伴わない高輝度領域がある場合,無症候でもイベントが発生する可能性が高いとされている。また,病理との対比では,高輝度の部分にヘモジデリン沈着と炎症が見られたとの報告もある1)。
また,Bモードでjelly fish signが見られ,さらにMRIで粥腫内出血が疑われる高信号領域がある場合,短期間で脳梗塞が再発することが多い2)。jelly fish signはプラークの破綻を示唆しており,Bモードでもこれまで困難だった深部の頸動脈プラークの性状評価が可能になると思われる。
さらに,イベントのリスクが高いとされる潰瘍については,かつては深さ2mm以上という定義があったが,Bモードの描出能の向上により,日本超音波医学会の「超音波による頸動脈病変の標準的評価法 2017」ではサイズの定義はされていない。Bモードでの評価に
ついては,感度が39〜89%,特異度が72〜89%とのデータがあるが,狭窄率が高くなると見逃しやすいという指摘もある3)。そこで,われわれは,このような不安定プラークの評価法として,造影超音波を施行している。
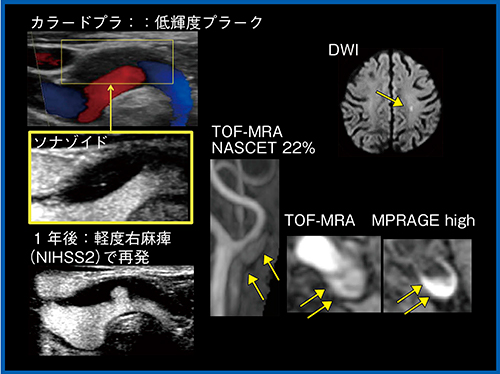
図1 軽度狭窄のある脳梗塞再発例
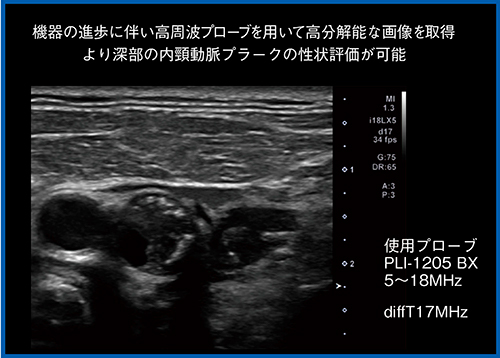
図2 17MHz高周波プローブによるプラークの性状評価
造影超音波を用いたプラーク不安定性の評価
ソナゾイドは,投与量が少量で,CTやMRIの造影剤と異なり極小の気泡のため,腎臓や肝臓を痛めずに呼気中に排泄され,安全性が高い。さらに,最大の特徴として,低音圧で共振しながら気泡を壊さずに長時間観察できるため,遅い血流や微細な血流を描出することが可能である。先に述べた潰瘍の評価においても,造影超音波は非造影よりも有用とされており,小さな潰瘍も同定でき,線維性被膜破綻を感度91%,特異度92%で同定可能であるとの報告がある3)。
こういった特徴から,造影超音波は,カラードプラでは乱流表示によって判断に迷う病変も,状態を確実に観察可能である。また,血管内腔が観察できるだけでなく,プラークの内部にできた新生血管の評価も行える。
われわれは,造影効果の定量評価も行った。造影超音波画像上では,プラークはショルダー部を中心に造影され,無症候性病変と比較して症候性病変の方が造影効果が高く,病理像とも相関していた。造影効果が高ければ不安定性が高いと評価できる4)。
造影超音波は,経過観察を行いやすいという利点もある。初発時のカラードプラで潰瘍が描出され,造影超音波で多数の新生血管が確認された軽度の狭窄がある症候性病変では,1年6か月後のカラードプラでは大きな変化が見られなかったが,造影超音波では多数の新生血管の近傍に新たな潰瘍ができているのを確認できた。
このように,造影超音波は,血管内腔を明瞭に描出でき,潰瘍や新生血管などプラーク内部の評価も可能という利点がある。一方で,造影の手技が必要となるほか,頻度は少ないものの副作用のリスクがあり,さらに保険適用になっていないという課題もある。そこで,われわれは,キヤノンメディカルシステムズのSMIを,非造影でのプラーク不安定性評価に応用した。
プラーク不安定性の評価におけるSMIの有用性
SMIは,従来のドプラ技術を刷新する新技術であり,低流速域におけるモーションアーチファクトを低減し,高感度,高分解能,高フレームレートで,非常に高精細な血流像を得られるという特長を有している。
図3の偽閉塞症例では,造影MRAでは血管を描出できず,カラードプラでも血管内腔を観察できないが,SMIでは血流が画像化され,開存していることがわかる。また,SMIは,プラークの評価でも有用である。図4のカラードプラでは,狭窄部の手前の血流が乱流で低流速となっており,狭窄部は高速流による乱流やブルーミングが発生している。このような場合,SMIでは,高分解能,高フレームレートにより,低流速と高流速の両方を描出し,プラーク全体の形態を把握することができる。さらに,低流速の血流を描出できることから,カラードプラやADFでは見ることのできないプラーク内の潰瘍も,SMIでは観察が可能である(図5)。SMIは非造影で観察できることから,フォローがしやすいという利点もある。
図6の高安動脈炎症例では,造影MRAで右総頸動脈に狭窄が見られるが,カラードプラではわずかに狭窄部の血管壁内に血流が認められた。SMIを用いたところ,外側からの血流が明瞭に描出されており,栄養血管であることが確認できた。このような動脈炎でも,SMIは視認性が良く,低流速の血流を観察できる。
SMIは,プラーク内新生血管の評価にも有用である。図7に示すとおり,カラードプラやADFでは描出されず,造影超音波でしか認められなかったプラーク内新生血管も,SMIを用いることにより,一部で視認できるようになった。このようにSMIは,造影剤を使用しなくても,微細で低流速の血流を描出でき,造影超音波の代替となる可能性を秘めている。
すでに,SMIを用いてプラーク内新生血管の評価について検討が行われ始めており,Ouraらは造影超音波とSMIでの描出を比較し,検者間格差も少なく,SMIは感度100%,特異度63%という高さで新生血管を描出できたと報告している5)。さらに,新生血管の視認性について増生の程度をgrade別にSMIと造影超音波を比較した別の報告でも,検者間の一致が良いと報告されている。病理との新生血管密度の対比では,一部が相関し,さらに臨床症状とも相関したと報告されている6)。アーチファクトや検出能など今後も比較研究による裏づけ,さらなる性能向上が待たれるが,このことから,造影超音波でしか見られなかった新生血管が,SMIでも描出できるようになってきていると言える。
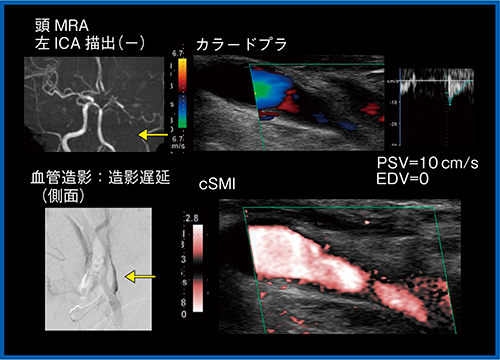
図3 偽閉塞症例におけるSMI(color-coded SMI:cSMI)
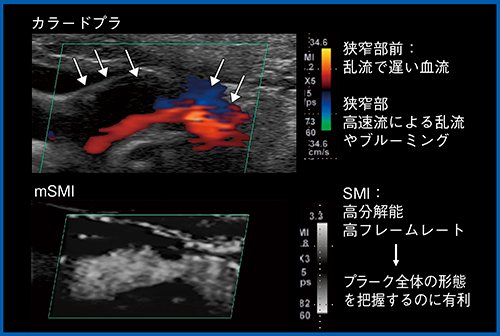
図4 SMIによるプラークの形態評価(monochrome SMI:mSMI)
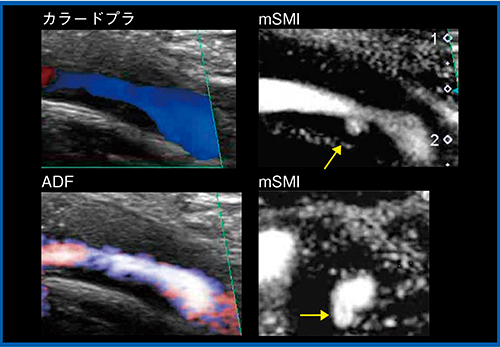
図5 SMIによる潰瘍の描出
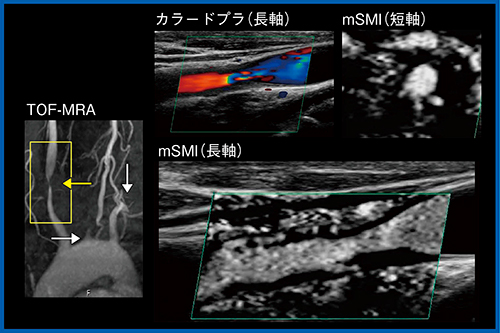
図6 高安動脈炎におけるSMI
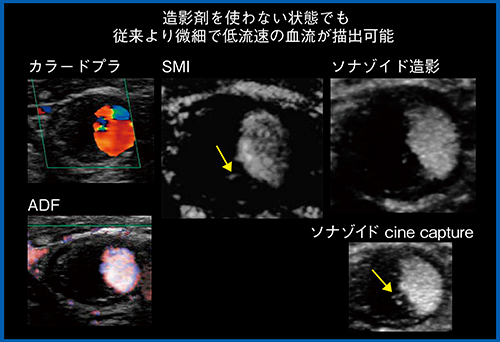
図7 SMIによるプラーク内新生血管の評価
まとめ
超音波診断装置の進歩に伴い,プラーク内部の評価においてBモードの質的診断能が向上している。また,プラーク不安定性の評価には,造影超音波が有用であるが,保険適用外などの課題がある。そこで,非造影で血流を評価できるSMIを用いることで,潰瘍や偽閉塞,新生血管,狭窄を伴うプラークの形態評価が可能となるとともに,プラーク内新生血管の評価にも有用性が期待される。
●参考文献
1)Carol, C., et al. : Transcranial Doppler and Microemboli Detection ; Relationships to Symptomatic Status and Histopathology Findings. Ultrasound Med. Biol., 43・9, 1861〜1867, 2017.
2)Kume, S., et al. : Vulnerable carotid arterial plaque causing repeated ischemic stroke can be detected with B-mode ultrasonography as a mobile component ; Jellyfish sign. Neurosurg. Rev., 33・4, 419〜430, 2010.
3)Yuan, J., et al : Imaging Carotid Atherosclerosis Plaque Ulceration ; Comparison of Advanced Imaging Modalities and Recent Developments. Am. J. Neuroradiol., 38・4, 664〜671, 2017.
4)Saito, K., et al. : Contrast-enhanced ultrasound for the evaluation of neovascularization in atherosclerotic carotid artery plaques. Stroke, 45・10, 3073〜3075, 2014.
5)Oura, K., et al. : Evaluation of Intraplaque Neovascularization Using Superb Microvascular Imaging and Contrast-Enhanced Ultrasonography. J. Stroke Cerebrovasc. Dis., 27・9, 2348〜2353, 2018.
6)Zhang, H., et al. : Comparison of diagnostic values of ultrasound micro-flow imaging and contrast-enhanced ultrasound for neovascularization in carotid plaques. Exp. Ther. Med., 14・1, 680〜688, 2017.

斎藤こずえ(Saito Kozue)
1998年 奈良県立医科大学卒業。同大学病院神経内科,国立循環器病研究センターを経て,2018年から奈良県立医科大学病院神経内科・脳卒中センター病院教授。
- 【関連コンテンツ】
