セミナーレポート(キヤノンメディカルシステムズ)
2018年6月8日(金),9日(土)の2日間,第37回日本脳神経超音波学会総会が神戸国際会議場・神戸ポートピアホテル(兵庫県神戸市)で開催された。8日に行われたキヤノンメディカルシステムズ株式会社共催のランチョンセミナー2では,岩手医科大学神経内科の寺山靖夫氏が座長を務め,奈良県立医科大学神経内科・脳卒中センターの斎藤こずえ氏と岩手医科大学脳神経外科の小笠原邦昭氏が,「プラーク不安定性評価法のup-to-date」をテーマに講演を行った。
2018年9月号
第37回日本脳神経超音波学会総会ランチョンセミナー2 プラーク不安定性評価法のup-to-date
プラーク不安定性評価法の臨床応用:MRI及び超音波を用いて
小笠原邦昭(岩手医科大学脳神経外科)
本講演では,MRIと超音波におけるプラーク不安定性評価法について講演する。超音波は,造影超音波検査とキヤノンメディカルシステムズの血流イメージング技術“Superb Micro-vascular Imaging(SMI)”による評価を,それぞれ報告する。さらに,数値流体力学(computational fluid dynamics:CFD)を用いた解析についても解説する。
CASとCEAにおける微小塞栓の発生
頸動脈狭窄症は,脳梗塞の主な原因であることがよく知られている。その治療には,頸動脈ステント留置術(CAS)が選択されることが多い。しかし,われわれは,虚血巣にステントを留置するよりも,塞栓源を確実に除去するために頸動脈内膜剥離術(CEA)を第一に選択している。頸動脈狭窄症の治療においては,合併症率を考慮することが重要であり,症候性病変では6%以下,無症候性病変では3%以下の合併症率で手術を行わなければならず,脳神経外科医は常に,それを念頭に置いておく必要がある。
CEAとCASの合併症としては,手術操作部位からの塞栓症,内頸動脈遮断による半球虚血といった脳虚血および過灌流が挙げられる。Spencerは,1997年にStroke誌において,CEAでは手術操作部位からの塞栓症が55%で最も多いと報告1)しており,CASも同様に手術操作部位からの塞栓症が高率に発症しやすい。このことから,CEA・CAS共に手術操作部位からの塞栓症に対する管理が重要である。
手術操作部位からの塞栓症として,CEAの場合,血管に触れることで血栓が飛んでしまう。また,CASは血管内にガイドワイヤを通すことで,血栓が飛んでしまう。そのため,われわれは経頭蓋超音波ドプラ検査(transcranial doppler:TCD)をルーチンで施行しており,すでに約800例のデータを蓄積している。実際の治療では,頸部挿管した後,TCD装置,近赤外線センサ,脳波計を設置してその情報をモニタリングしており,血栓が飛んだ場合はTCD装置で微小塞栓信号(microembolic signal:MES)を確認することができる。
CEAの手順は,皮切から頸動脈遮断直前までの「頸動脈露出期」,頸動脈遮断からプラークを摘出して頸動脈を縫合し遮断を解除するまでの「プラーク摘出期」,そして,頸動脈遮断解除直後から手術終了までの「閉創期」という3つのフェーズに分けることができる。この中で,頸動脈露出期に発生するMESが最も危険な存在であり,固形物による微小塞栓が術後の脳虚血巣や脳虚血症状に関与していると,1990年代から指摘されている2)〜4)。
われわれが行ったCEAの初期163例の結果では,頸動脈露出期におけるMESの発生頻度は31.9%となっており,MRIの拡散強調画像ではそのうちの17.2%で新たな虚血巣の発生を確認した。さらに,4.9%(約1/3)が症候性であり,その多くは一過性脳虚血(TIA)で,完成卒中は1.2%(約1/4)であった。
この結果を踏まえて,われわれは,微小塞栓の発生および微小塞栓による脳虚血巣出現のメカニズムと予知,対策について検討を行った。微小塞栓は,出血主体の動脈硬化巣を持つ症例において,CEAでの頸動脈露出中に発生しやすいという報告がある4),5)。また,病理学的には,出血主体の動脈硬化巣はプラークの表面(血流面)に血栓が存在しており,手術時に刺激を与えることで飛んでしまうという指摘もある6)。これらのメカニズムが正しければ,出血主体の動脈硬化巣の存在を術前に知ることによって,微小塞栓の発生を予知することが可能である。
そこで,われわれは,MRIと超音波による頸動脈プラークイメージングでの検討を行った。
MRIによる頸動脈プラークイメージング
齋藤らは,MRIのnon-gated spin echo法による頸動脈プラークイメージングにおいて,線維成分が主体のプラークは胸鎖乳突筋とほぼ等信号であるが,脂質主体のプラークでは高信号となり,出血の場合はさらに高信号となったと報告している7)。このことから,相対的信号強度が高いと血栓が飛びやすく,低いと飛びにくいと考えられる。
この報告を踏まえて,術前のnon-gated spin echo法でのプラークイメージングで,頸動脈露出操作中のプラークからのMESの発生を予知できるかを検討した。図1は,72歳,男性の右頸部内頸動脈狭窄症の術前MRIプラークイメージングで,プラークが高信号に描出されている。本症例では実際に,術中にMESが出現している。
多数例での前向き研究で検討すると,術前のnon-gated spin echo法上相対的信号強度が高いプラークは,頸動脈露出操作中にMESが発生しやすかった8)。ただし,相対的信号強度の値によっては,MESが発生する範囲としない範囲が重なっており,厳密な線引きができないため,この結果を臨床に応用するのは難しいと考える。
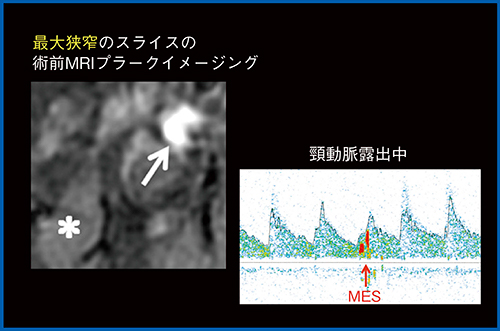
図1 右頸部内頸動脈狭窄症(72歳,男性)の術前プラークイメージング
超音波による頸動脈プラークイメージング
1.造影超音波による頸動脈プラークイメージング
超音波による頸動脈プラークイメージングとして,まずプラークの表面付近のgray scale median(GSM)を算出し,さらにソナゾイドによる造影超音波を行った。ソナゾイド造影では,投与後17秒前後から血管の内腔が染まり,さらに約23秒後からはプラークも濃染する。一方,斎藤らは,プラークの増強効果と血管新生には,正の相関があると報告している9)。プラークの増強は血管新生が強いことを示しており,さらに,プラークが脆弱で血栓が飛びやすいことを示唆している。この推論が正しければ,ソナゾイドによるプラーク増強効果の程度を見ることで,頸動脈露出操作中のプラークからのMESの発生を予知できる可能性がある。
そこで,ソナゾイドによるプラーク増強効果を相対的に見るために,プラーク付近にROIを設定し(図2),さらに血管内腔にもROIを設けてtime intensity curve(TIC)を作成し,GSMとの違いを見た(図3)。プラーク付近と血管内腔のピークの比率を算出するために,われわれは心臓エコー用のソフトウエアを改良した専用ソフトウエアを開発した。このソフトウエアで算出された比率からMESの発生の有無を見ると,GSMでは発生の有無を予知するのは困難であった。一方,造影超音波では,MESの発生の有無が明確に判断でき,MES発生症例の方がプラーク増強効果が高いことが明らかになった。また,ROC曲線を見ると,GSMよりも造影超音波の方が感度と特異度が高いことが示された。このことから,造影超音波は,頸動脈露出操作中におけるプラークからのMESの発生を,非造影検査よりも高い精度で術前に予知できると言える10)。
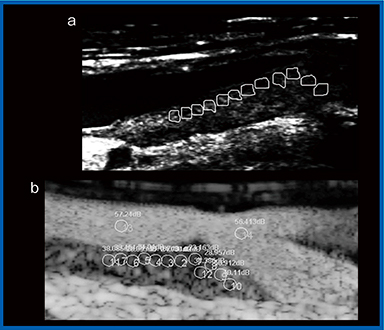
図2 GSMとソナゾイド造影超音波でのROI設定
a:GSM
b:相対的造影剤増強効果
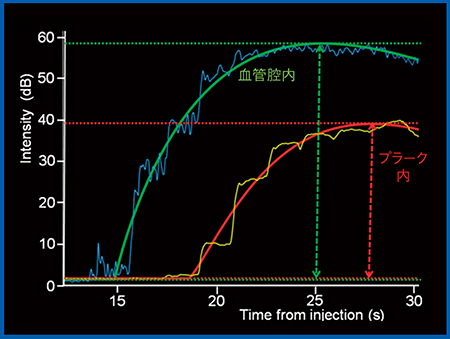
図3 ソナゾイド造影超音波における血管内腔とプラークのTIC
2.SMIによる頸動脈プラークイメージング
しかし,ソナゾイドによる頸部の造影超音波検査は,本邦においては保険適用外である。そこで,われわれは,造影剤を用いずにプラーク内の血流を見るために,キヤノンメディカルシステムズの血流イメージング技術であるSMIでの検討を行った。
SMI上で,血管内腔とプラークにそれぞれROIを設定し,時間ごとのintensityを見ていくと,収縮・拡張により血管内腔は大きく変動して,プラークもわずかに上下しているのが定量できる(図4)。このことを踏まえると,収縮・拡張を加算して平均化した比を取った値は,血管新生の程度と比例すると考えられる。さらに,SMI上の規則的な信号変化とプラークの病理との相関を見ることで,MESの発生を術前に予知できる可能性がある。
しかしながら,MESの発生をより明確に予知するためには,MRI,造影超音波でのプラーク性状の検討だけでなく,ほかの因子の影響を考える必要がある。その因子として,塞栓子を下流に持っていく力の強さ,すなわち流体が考えられた。
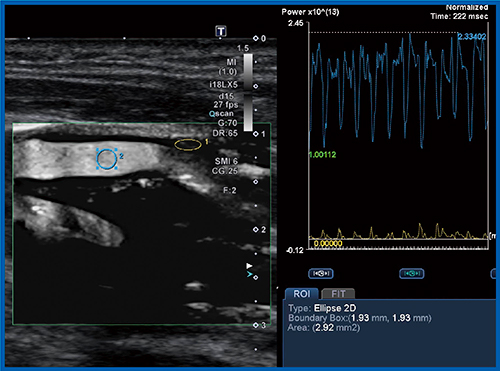
図4 SMIによる血管内腔とプラークのintensityの定量
CFD解析を用いたプラーク不安定性評価
そこで,われわれはCFD解析を行うこととした。CFDは脳動脈瘤の破裂などを予知する技術として研究が進んでいるが,われわれはMRIのプラークイメージングを基に,流速(flow speed)と剪断応力(wall shear stress:WSS)のマッピングを行った(図5)。狭窄率およびプラークイメージングの相対的信号強度はほぼ同じであったものの,WSSの値には症例により大きな違いが見られた。さらに,同程度の相対的信号強度であれば,WSSが高い方にMESが発生しやすいことが明らかになった11)(図6)。
また,われわれが行ったMRIのプラークイメージングでは,相対的信号強度が1.16以下だとMESが発生しないという結果が出ている。つまり,相対的信号強度が1.17未満の場合は,線維成分が主体であり,線維成分ではMESは発生しないと言える。そして,1.17以上の相対的信号強度のプラークにおいてMESが発生するため,このプラークに対してCFD解析を行うことで,予知が可能になると考えられる。
このことを踏まえ,われわれは70%以上の高狭窄率症例において,MRIのプラークイメージングで相対的信号強度が1.17以上の脂質・出血主体のプラークを有する54例を対象に,相対的信号強度,WSSと,CEA中のMES発生との関係を検討した。その結果,相対的信号強度が高いとMESが発生し,WSSも高いほどMESが発生していた。相対的信号強度が1.4以上の場合,陽性適中率は66%の確率で,WSSが50Pa以上ならば90%の陽性適中率でMESが発生している。さらに,相対的信号強度とWSSの両方が高い場合,陽性適中率が90%,陰性適中率が85%と,非常に高い確率でMESが発生するという結果が得られた。
術前のプラークイメージングとCFD解析により高リスクと診断した場合,内頸動脈露出操作中にMESを発生させないようにすることが重要である。この対策としては,頸動脈を早期に遮断して,flow reversalを行う。早期遮断によって血流を頭部から心臓へと逆流させることで,MESの発生を抑え,治療を進めることが可能となる。ただし,これは高リスクの患者に対してのみ行う方法だと考えている。
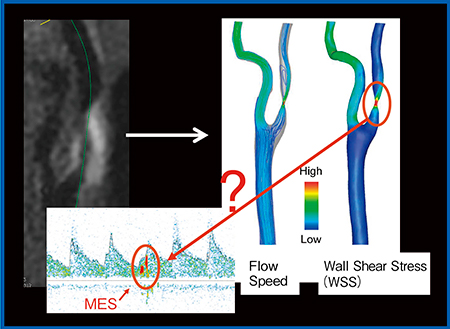
図5 CFD解析によるflow speedとWSSのマッピング
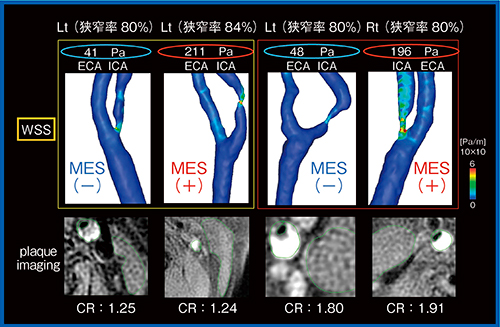
図6 MRIの頸動脈プラークイメージングとCFD解析でのWSSの比較
まとめ
MESの発生は,MRIと超音波によるプラークイメージングから予知できる。さらに,CFD解析を行うことで,より高精度で予知できるようになる。一方,CFD解析は,「なぜ狭窄率が高ければ症候化するのか」という問いに,一つの答えを示していると言えるだろう。
●参考文献
1)Spencer, M.P. : Transcranial Doppler monitoring and causes of stroke from carotid endarterectomy. Stroke, 28・4, 685〜691, 1997.
2)Gaunt, M.E., et al. : Vascular endoscopy ; Useful tool or interesting toy. Br. J. Surg., 81・10, 1542, 1994.
3)Wolf, O., et al. : Microembolic signals detected by transcranial Doppler sonography during carotid endarterectomy and correlation with serial diffusion-weighted imaging. Stroke, 35, e373~e375, 2004.
4)Verhoeven, B., et al. : Carotid atherosclerotic plaques in patients with transient ischemic attacks and stroke have unstable characteristics compared with plaques in asymptomatic and amaurosis fugax patients. J. Vasc. Surg., 42・6, 1075~1081, 2005.
5)Altaf. N., et al. : Carotid intraplaque hemorrhage detected by magnetic resonance imaging predicts embolization during carotid endarterectomy. J. Vasc. Surg., 46・1, 31〜36, 2007.
6)van Dijk, A.C., et al. : Intraplaque Hemorrhage and the Plaque Surface in Carotid Atherosclerosis ; The Plaque At RISK Study(PARISK). Am. J. Neuroradiol., 36・11, 2127〜2133, 2015.
7)Saito, A. et al. : Carotid plaque signal differences among four kinds of T1-weighted magnetic resonance imaging techniques ; A histopathological correlation study. Neuroradiology, 54・11, 1187〜1994, 2012.
8)Sato, Y. et al. : Optimal MR Plaque Imaging for Cervical Carotid Artery Stenosis in Predicting the Development of Microembolic Signals during Exposure of Carotid Arteries in Endarterectomy ; Comparison of 4 T1-Weighted Imaging Techniques. Am. J. Neuroradiol., 37・6, 1146〜1154, 2016.
9)Saito. K., et al. : Contrast-enhanced ultrasound for the evaluation of neovascularization in atherosclerotic carotid artery plaques. Stroke, 45・10, 3073〜3075, 2014.
10)Oikawa, K., et al. : Preoperative cervical carotid artery contrast-enhanced ultrasound findings are associated with development of microembolic signals on transcranial Doppler during carotid exposure in endarterectomy. Atherosclerosis, 260, 87〜93. 2017.
11)Oshida, S., et al. : Wall shear stress and T1 contrast ratioare associated with embolic signals during carotid exposurein endarterectomy. Stroke(in press).

小笠原邦昭(Ogasawara Kuniaki)
1984年 弘前大学医学部卒業。東北大学脳神経外科に入局。95年 広南病院脳神経外科。98年 岩手医科大学脳神経外科講師。2001年 助教授。2008年から教授となり,2018年に岩手医科大学医学部附属病院病院長。
- 【関連コンテンツ】
