セミナーレポート(キヤノンメディカルシステムズ)
第54回日本小児循環器学会総会・学術集会が,2018年7月5日(木)〜7日(土)の3日間,パシフィコ横浜(神奈川県横浜市)で開催された。6日に行われたキヤノンメディカルシステムズ株式会社共催のランチョンセミナー9では,長野県立こども病院循環器センターセンター長の安河内 聰氏が,「先天性心疾患における3D Speckle Trackingエコー法の応用」をテーマに講演を行った。
2018年10月号
第54回日本小児循環器学会総会・学術集会ランチョンセミナー9
先天性心疾患における3D Speckle Trackingエコー法の応用
安河内 聰(長野県立こども病院循環器センター)
先天性心疾患(CHD)における3Dエコーの有用性は広く知られている。主に形態学的な評価に用いられてきたが,最近では機能的評価が行われるようになっている。本講演では,キヤノンメディカルシステムズの超音波診断装置「Aplio i900」に搭載された3D Speckle Trackingエコー法のアプリケーションの“3D Wall Motion Tracking(3D-WMT)”を用いた,CHDにおける心腔と心筋壁の動態評価を中心に述べる。
3D Speckle Trackingとは
従来の2D Speckle Trackingには,対象が断面から外れてしまうThrough-Plane現象という問題があるが,3D Speckle Trackingはボリュームデータを取得するため,この問題がなく心臓の立体構造を理解しやすいという利点がある。CHDの2Dエコーからの3D構築ではなく,3Dエコーで評価することは重要であり,2D断面上にない構造物の影響の評価も可能となる。
正常右室でも2Dエコーによる評価には限界がある。4 chamber viewによる右室機能評価は右室流入部の機能評価であり,右室全体機能評価のためには右室流出路を含めた評価が必要である。3Dエコーはこの点において,右室全体の機能評価を可能にし,さらに局所心筋の動きの評価も可能とする。
2D Speckle Trackingでは,Through-Plane現象という問題を軽減するためにhigh frame rateが必要で,患者の心拍と同等以上,または100fps以上で撮像する。一方,キヤノンメディカルシステムズ社の3D Speckle Trackingである3D-WMTでは30〜50vps程度でも十分に評価できる。また,データ収集においては,多断面を収集する必要がある2D Speckle Trackingに対して,3D-WMTはフルボリュームスキャンにより全方向の解析が可能であり,空間分解能も向上している。
3D-WMTによるCHDの機能評価
1.ストレイン評価
心筋の動きには,短軸方向(radial),円周方向(circumferential),長軸方向(longitudinal)の3方向の動きがある1)。断面上の動きを観察できる2D Speckle Trackingは,短軸断面では短軸方向と円周方向のストレイン,長軸断面では長軸方向のストレインを観察できるのに対し,3D-WMTでは,円周方向と長軸方向への動き成分を含む三次元的な壁厚変化率を意味する3Dストレインを評価することができる。三次元構造としての解析が必要な,複雑な立体構造のCHDにおいては,3D-WMTによる3Dストレインが有用となる。
3D-WMTでは,三次元空間的にねじれ関係にあるズレを見ることができる2)。左心低形成症候群(HLHS)のFontan術後の評価では,2D Speckle Trackingのradialストレインと比べ,3D-WMTの3Dストレイン(図1)の方が局所ごとの収縮に差異があることが明瞭にわかる。
HLHSのFontan術後に3D-WMTによるストレインで右室機能を評価したわれわれの検討では,正常左室群とストレインカーブを比較すると,すべての方向のストレインが低下していた。また,3Dストレインも低下しており,ストレインのピーク時間は延長していた。このような評価は,多断面で評価する2D Speckle Trackingでは難しく,3D-WMTを用いることで容易に評価できる。ただし,ストレイン解析については装置のベンダーによって計測値に相異があると報告3)されており,解析の際には注意が必要である。
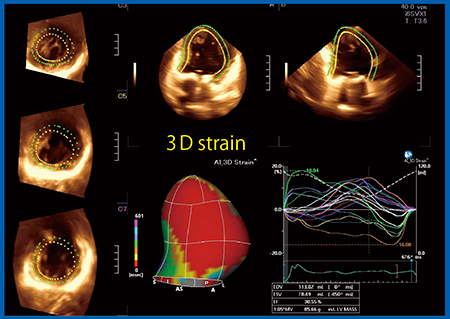
図1 HLHS Fontan術後(15歳)の3D-WMTによる3Dストレイン
2.Torsion/Twist評価
心臓の機能評価の指標に用いられる左室心筋のねじれ(Torsion/Twist)の評価にも,3D-WMTが有用である。
図2は,HLHSのFontan症例で,体循環心室の右室にねじれがあるかを3D-WMTで確認した。ねじれがある部分は,Twistのカラーマップ(図2中央下段)では赤〜黄色で表されるが,本症例はねじれが少ないことがわかる。図3は,純型肺動脈閉鎖(PAIVS)のFontan症例で,体循環心室の左室にねじれがあることがわかる。共に体循環心室であるが,解剖学的右室の場合はねじれがなく,解剖学的左室の場合はねじれがあることが,3D-WMTで確認できる。
これまでの経験では,右室については体循環心室,肺循環心室のいずれでもTorsionは発生せず,左室については,体循環心室でも肺循環心室でも,また,修正大血管転位の左室であってもTorsionが発生することがわかっている。
3D-WMTによるTorsion/Twist評価は,2D Speckle Trackingによる評価と異なり,時相や空間的なズレがなく,測定誤差が少ないことから,より正確な生理学的,病理学的解析が可能である。
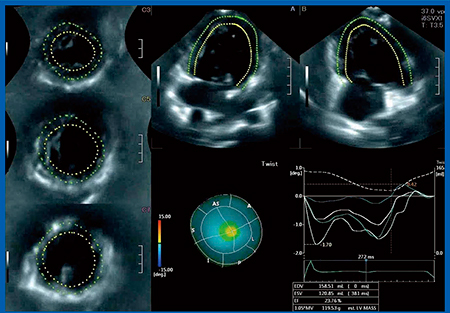
図2 体循環心室右室の3D-WMTによるねじれの解析
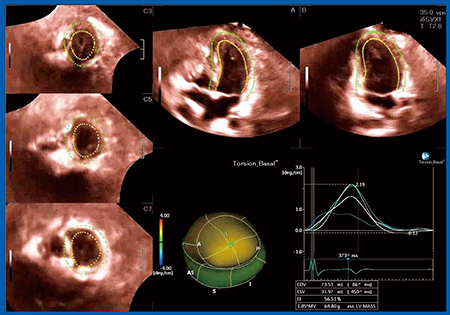
図3 体循環心室左室の3D-WMTによるねじれの解析
3.Quad Chamber Tracking
心臓の機能評価においては,心室間,心房−心室間,心房間の相互作用の評価も重要である。
図4は,総動脈幹症に対してRestelli手術を施行した症例(10歳,女児)について,右室専用の3D-WMTと左室専用の3D-WMTでそれぞれ解析された右室と左室を,Quad Chamber Tracking機能により組み合わせたものである。両心室における面積変化率(Area Change ratio:ACR)のカラーマップ(図4左)では,どの部位が収縮し,どの部位が収縮していないかを視覚的に把握でき,ボリュームカーブ(図4右上)では,左室と右室のボリューム変化が時相をそろえて表現されている。従来の3D Speckle Trackingエコー法では,右室機能,左室機能それぞれの評価にとどまっていたが,実際には左室と右室はつながっているため,相互作用を評価しなければならないだろう。
図5は,HLHSの左房と右室の関係を見たもので,収縮に応じて左房と右室が相互に作用していることがわかる。Fontan症例では心房不良や心房肥大も多いため心房機能評価は重要だが,心房の動きには心室のボリュームも影響するため,このような機能を用いて同時に解析,評価することは有用である。
なお,Quad Chamber Trackingでは四腔を同時に評価することも可能で,右房,左房,右室,左室をそれぞれ解析して統合し,拡張・収縮のタイミングや四腔の相互作用を総合的に評価することができる。Quad Chamber Trackingは,心腔間の相互干渉,相互作用機序の解明に有効であり,三次元的ねじれの解析による新たな機能解析,四腔を合わせた統合的心機能解析の可能性があると考えられる。
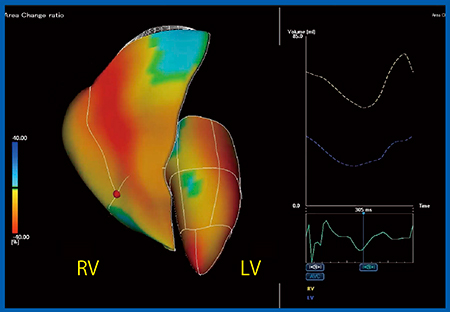
図4 Quad Chamber Tracking:総動脈幹症に対するRestelli術後の右室と左室
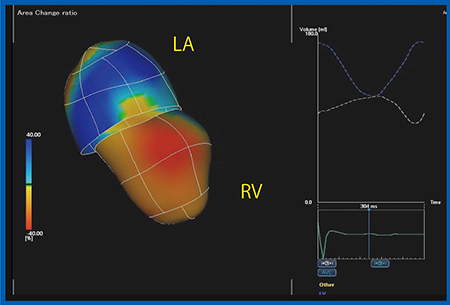
図5 Quad Chamber Tracking:HLHSの左房と右室
4.左房機能評価
3D-WMTでは,左房の解析も可能である。左房機能について,正常例(図6 a),心房中隔欠損に対するカテーテル治療(アンプラッツァー法:ASO)例(図6 b)と外科的治療例(図6 c)を比較すると,ASOでは左房機能の低下が認められる。また,外科的治療例においても正常例と比較すると,術後5〜10年で左房機能の低下が認められる。ASOや外科的治療の経過観察における,心房機能や不整脈の発生の評価に3D-WMTは有用である。
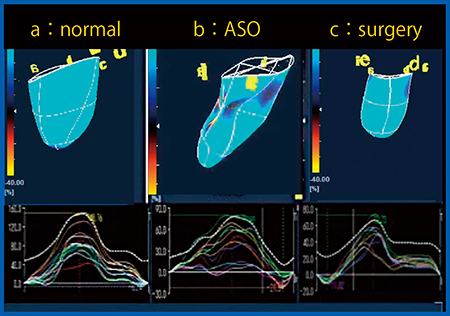
図6 3D-WMTのACRによる左房解析
CHDにおけるActivation Imaging
キヤノンメディカルシステムズ社と筑波大学の瀬尾らが共同開発したアプリケーション“Activation Imaging(AI)”は,心室の電気的興奮と機械的興奮との対応から電気生理検査に近い情報を得ることができる。3D-WMTによるAIでは,局所の機械的な収縮を経時的にカラーマッピングすることで,興奮の伝搬を把握することが可能となる。瀬尾らは,ストレインの閾値レベル25%のAIが,仮想収縮開始時間として電気的興奮時間に対応すると報告している4)。
正常小児の興奮伝搬は,解剖学的左室の乳頭筋付着部付近から心尖部を回るように伝搬し,右室流出路に向かうことが知られている。われわれは,体循環心室右室の電気的興奮伝搬が,どのように機械的収縮様式に影響するか検討を行った。HLHSのFontan術後症例(5例)を対象に,心尖部四腔断面で体循環心室右室のボリュームデータを取得し,3D-WMTによってACRを計測した。AIによる体循環心室右室の興奮伝搬の様子はACRを用いた閾値20%設定で最も良好に表示されたため,収縮開始点を基点としてACRの本設定を用いたAIにより局所心筋のdeformation siteを算定し,polar mapおよびplastic bag mappingに展開して興奮伝搬を可視化した。
その結果,HLHSの体循環心室右室における興奮伝搬は,右室心尖部三尖弁前乳頭筋付着部付近から長軸方向に旧肺動脈弁下右室流出路方向へと伝搬していた(図7)。なお,体循環心室左室のFontan術後患者では,中隔基部と左室乳頭筋付近から興奮活動が起こり,左室全体に伝搬していることがAIで確認できた(図8)。現時点では症例数が少ないため,今後検討を重ねる必要がある。
大血管転換症や修正大血管など,CHDの種類ごとに本来あるべき(=正常な)電気的興奮伝搬というものがある。AIは,そのような“正常”のCHDにおける電気的興奮−機械的収縮連関を解明するツールとなりうるだけでなく,病的心における電気的興奮−機械的収縮連関様式異常の解明や,ECカップリングの視点からの治療効果判定にも有用であると考えている。
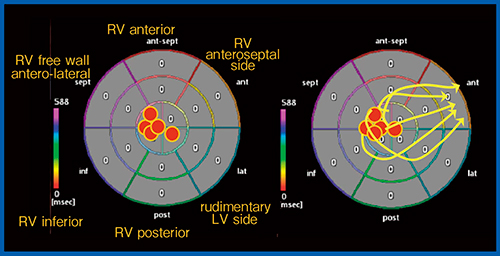
図7 Activation Imagingによる体循環心室右室の興奮伝搬(HLHS 5例)
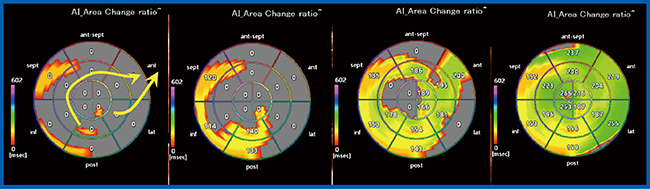
図8 Activation Imagingによる体循環心室左室の興奮伝搬
その他のAplio i900の有用性
Aplio i900の新しいコンベックスプローブ「i8CX1」では,胎児心筋ストレインと肝臓エラストグラフィの計測も可能である。
1.胎児心筋ストレイン
図9は,胎児心エコーで左室のglobal longitudinal strainを計測している。Aplio i900の2D Speckle Trackingアプリケーションである“2D Wall Motion Tracking”では,セミオート設定でストレイン計測が可能である。注目すべきは,i8CX1では,胎児心筋の2D画像によるストレイン解析に必要な空間分解能と時間分解能(>100fps,本症例では138fps)が得られる点で,拡張末期容量(EDV),収縮末期容量(ESV),駆出率(EF)が自動で算出される。測定の妥当性の検討は必要だが,胎児のレベルでも左室や右室のストレイン解析が可能であり,胎児心筋機能解析の新たなツールとなる可能性がある。
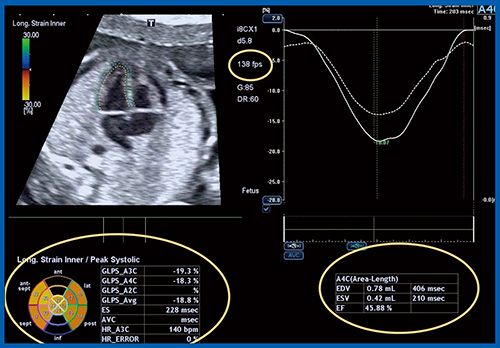
図9 胎児心エコーでの左室global longitudinal strain計測
2.肝臓エラストグラフィ
Fontan術後は肝臓が硬くなるため,われわれは術後に肝硬度を測定している。従来は専用装置であるFibroScanを使用していたが,i8CX1により肝臓エラストグラフィが可能となった(図10)。Aplio i900には,“Liver Package”が搭載されており,減衰表示(ATI),ディスパージョン表示(SWD),弾性表示(SWE),造影表示(CHI)を用いて,肝疾患のステージに適したツールで肝臓を評価することができる。このうち,新しい概念であるSWDは,周波数によって弾性(速度)が変わる特徴を利用して,速度曲線の傾きから粘性を評価する方法である。
Fontan術後の肝硬度は,感染症の合併がなくても10kPaを超える。われわれのデータでは,FibroScanで23.9kPaを超えると炎症的にも組織的にも明らかに肝硬変となる症例が多いが,数値的にそこまで至らない肝臓について,SWDを使うことで実際に組織的に硬いのか,炎症などほかの影響によるものかを鑑別できる可能性がある5)。Aplio i900を用いたエラストグラフィは,測定が容易で測定値も安定している。今後は,多施設共同研究などで硬さと粘性の評価を行っていく必要があると考える。
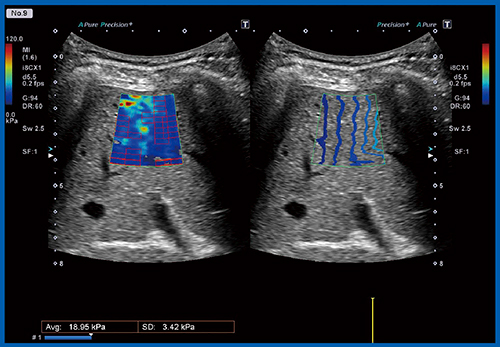
図10 肝臓エラストグラフィ〔三尖弁閉鎖症,21歳のFontan関連肝疾患(FALD)例〕
まとめ
小児循環器領域におけるAplio i900は,1台で胎児から成人まで検査が可能で,3D/2D Wall Motion Trackingによる機能解析,AIによる興奮−収縮連関解析,エラストグラフィが行えるという有用性がある。
さまざまな解析が可能となっているが,心エコーを行う上で大切なことは,何を見たいか見ているものが何に影響されているかを認識することである。心機能評価では,それぞれ単独の機能評価だけではなく,空間的,時間的相互作用を考えることも重要である。
●参考文献
1)Cheung, YF., Nat. Rev. Cardiol., 9, 644〜657, 2012.
2)Seo, Y., et al., Circ. J., 78, 1290〜1301, 2014.
3)Farsalinos, K.E., et al., J. Am. Soc. Echocardiogr., 28, 1171〜1181, 2015.
4)Seo, Y., et al., Circ. J., 77, 2481〜2489, 2013.
5)齊川祐子,安河内 聰・他, 日本超音波医学会第91回学術集会 一般口演(S602), 2018.

安河内 聰(Yasukochi Satoshi)
信州大学医学部卒業。横須賀
米海軍医療センター,信州大学小児科を経て,東京女子医科
大学心臓血圧研究所で高尾篤良氏に師事し小児循環器学を学ぶ。1990〜93年 米国・Johns Hopkins大学,Cornell大学に留学,93年 長野県立こども病院循環器小児科,2002年 同部長,2012年 同エコーセンター長,2014年より同循環器センター長。
- 【関連コンテンツ】
