セミナーレポート(キヤノンメディカルシステムズ)
第78回日本医学放射線学会総会が2019年4月11日(木)〜14日(日)の4日間,パシフィコ横浜(神奈川県横浜市)で開催された。13日(土)に行われたキヤノンメディカルシステムズ株式会社共催ランチョンセミナー12では,神戸大学大学院医学研究科内科系講座放射線診断学分野教授の村上卓道氏が司会を務め,横浜市立大学大学院医学研究科放射線診断学教授の宇都宮大輔氏,岩手医科大学医学部放射線医学講座主任教授の吉岡邦浩氏,広島大学大学院医系科学研究科放射線診断学教授の粟井和夫氏が,「CT最前線〜AI技術を搭載した次世代CTと検査〜」をテーマに講演を行った。
2019年7月号
第78回日本医学放射線学会総会ランチョンセミナー12 CT最前線〜AI技術を搭載した次世代CTと検査〜
Adamkiewicz動脈の描出と進歩
吉岡 邦浩(岩手医科大学医学部放射線医学講座)
大動脈瘤の術後対麻痺(脊髄虚血)は,両下肢に神経障害を引き起こす重篤な合併症であり,「大動脈瘤・大動脈解離診療ガイドライン(2011年改訂版)」には,術後対麻痺の発生率は平均10%と記載されている。そこで,術前に脊髄の栄養血管であるAdamkiewicz動脈を分岐する肋間動脈や腰動脈をCTで描出し,手術の際に再建あるいは温存して脊髄の血流を確保することで,術後対麻痺を回避できると考えている。
本講演では,CTによるAdamkiewicz動脈の描出の進歩について,キヤノンメディカルシステムズ社の超高精細CT「Aquilion Precision」,逐次近似再構成法“FIRST”による描出の有用性を中心に述べる。
Adamkiewicz動脈の解剖とCT画像診断
Adamkiewicz動脈の術前画像診断の有効性の検証を目的に,わが国で行われた大規模研究が“JASPAR研究”1)である。本研究では,Adamkiewicz動脈の同定とその所見に基づいた大動脈瘤手術は術後対麻痺回避に有効であることが証明されており,この結果を受けて,現在,前述のガイドラインの改訂が進められている。
Adamkiewicz動脈は脊髄の尾側1/3を栄養する血管で,第7肋間〜第2腰動脈のいずれか1本から分岐し,右側よりも左側から起始することが多い。太さは1mm程度で,前脊髄動脈と合流するところで特徴的なhairpin turnを描き(図1a),また,形態は個人差が大きいことが知られている。CTによるAdamkiewicz動脈の診断で最も注意すべきは,静脈も同じようなhairpin turnを描くことであり,症例ごとに形態からその場で判断することは困難である。大動脈から肋間動脈,Adamkiewicz動脈,前脊髄動脈までの連続性を一筆書きのように描出できれば(図1b),Adamkiewicz動脈であることを正確に診断できると考える。
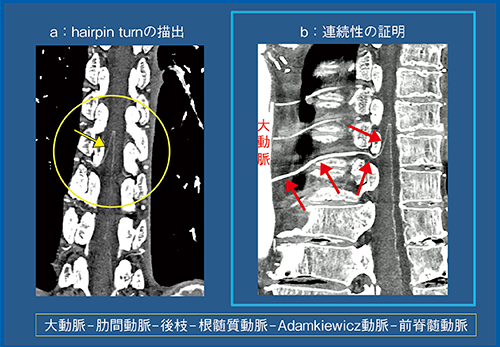
図1 Adamkiewicz動脈の大動脈から前脊髄動脈までの連続性の証明
従来CTによる描出能
従来CT(16/64列,スライス厚 0.5mm)によるAdamkiewicz動脈の描出率を検討したいくつかの報告を見ると,hairpin turnは80〜100%と高率に描出されるが,連続性の証明については50〜60%に低下する。これは,Adamkiewicz動脈は椎間孔から脊柱管内に入るところで骨と近接し,連続性を追えなくなるためである。また,スライス厚 1mmでも連続性の証明は50%であり,スライス厚 0.5mmと1mmでは差がほとんどないことがわかる。
超高精細CTによる描出能
超高精細CT AquilionPrecisionは,スライス厚 0.25mmを実現しており,従来CT(スライス厚 0.5mm)の8倍の空間分解能を有する。Aquilion Precisionを用いることで,Adamkiewicz動脈の連続性を,より明確に把握できるようになることが期待される。
実際の画像(図2)を見ると,従来CTでは骨と近接する血管を分離するのが難しいが(b,d),Aquilion Precisionでは鑑別が容易である(c,e)。
そこで,当院の24症例を対象に,Adamkiewicz動脈の診断精度について,同じデータをスライス厚 0.5mmと0.25mmで再構成して比較した。その結果,連続性の証明は,スライス厚 0.5mmは66.7%,0.25mmは91.7%と,0.25mmの方が有意に診断精度が向上していた2)。
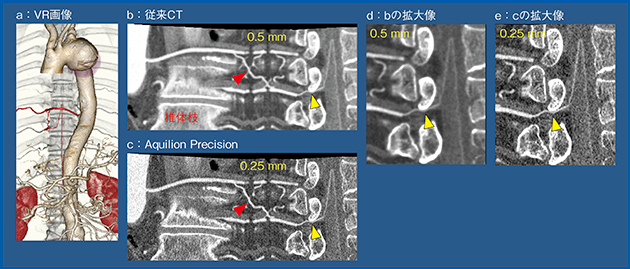
図2 Aquilion Precisionによる骨と血管の鑑別
描出能をさらに向上させるFIRST
1.Adamkiewicz動脈の連続性の証明における有用性
超高精細CTに,完全な逐次近似再構成法(Full IR)のFIRSTを併用した場合のAdamkiewicz動脈の描出について検討を行った。
図3は,スライス厚 0.25mmのデータを逐次近似応用再構成法の“AIDR 3D”とFIRSTで再構成した画像であるが,0.25mm+FIRST(b)の方が骨と血管の鑑別がより容易であった。
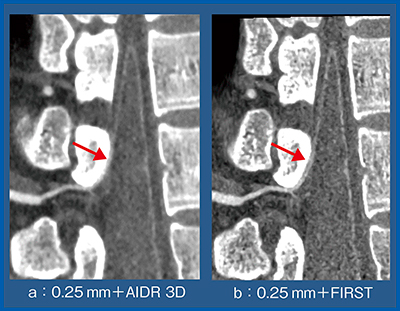
図3 スライス厚 0.25mmにおけるAIDR 3D(a)とFIRST(b)の比較
0.25mm+FIRSTの画像は,臨床においても非常に有用である。症例1(図4)は大動脈解離術前で,0.5mm+AIDR 3D(a)では骨と血管の分離が困難であるが,0.25mm+FIRST(c)ではAdamkiewicz動脈の連続性を確実に判定可能である。超高精細CTとFIRSTは,非常に相性が良いと実感している。
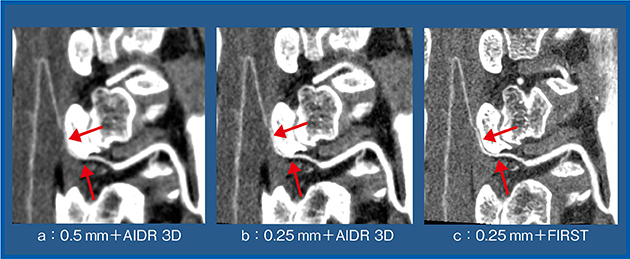
図4 症例1:大動脈解離術前の動脈の連続性の評価
2.側副血行路の診断における有用性
0.25mm+FIRSTは,側副血行路の診断にも非常に有用であることがわかってきた。
側副血行路について検討したところ,Adamkiewicz動脈を分岐する肋間・腰動脈の約1/4は閉塞して側副血行路を形成することがわかってきた。当院の検討では,側副血行路は脊椎周囲の動脈(後椎体枝,椎体枝など)と胸壁の動脈(胸背動脈,内胸動脈など)を介する
2つの経路があり,そのうちの85%は脊椎周囲にあった3)。つまり,ほとんどの側副血行路は骨の近傍を走行していることになる。症例によっては,脊柱管の周囲をとぐろを巻くような複雑な経路をたどる側副血行路もあり,そのような症例には,やはり0.25mm+FIRSTが有効であると思われる。
症例2(図5)は,Crawford Ⅳ型の大動脈瘤であるが,0.25mm+FIRST(c)にて側副血行路が形成されたAdamkiewicz動脈が描出され,血管の連続性も明確に証明されており,この部分が栄養血管であるという情報を外科医に提供することができた。その結果,人工血管置換と肋間動脈の再建にて術後の血流が確保され,本症例は術後対麻痺を来すことなく退院できた。
このように,側副血行路が正しく診断できれば,手術方針や術式にも影響を与えることができると思われる。
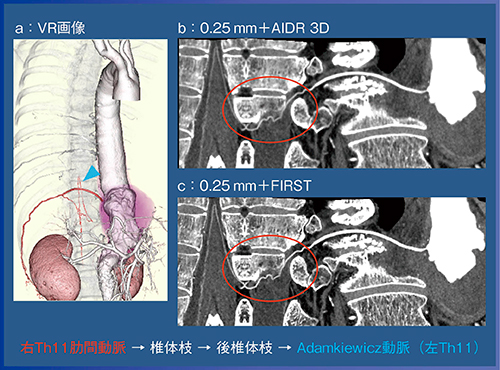
図5 症例2:Crawford Ⅳ型大動脈瘤における側副血行路の連続性の証明
まとめ
超高精細CTによるAdamkiewicz動脈の描出率は,約90%であった。また,超高精細CT+FIRSTは,血管の連続性の証明と側副血行路の描出が期待できる。
●参考文献
1)Tanaka, H., et al., J. Thorac. Cardiovasc. Surg., 151・1, 122〜128, 2016.
2)Yoshioka, K., et al., Neuroradiology, 60・1,109〜115, 2018.
3)Yoshioka, K., et al., Eur. J. Cardiothrac. Surg., 54・1, 19〜25, 2018.

吉岡 邦浩(Yoshioka Kunihiro)
1985年 岩手医科大学卒業。同附属病院,同医学部放射線医学講座を経て,97年に同附属循環器医療センター放射線科。2004年 同医学部放射線医学講座助教授。2012年 同附属病院循環器放射線科教授。2019年4月より同医学部放射線医学講座主任教授。
- 【関連コンテンツ】
