セミナーレポート(キヤノンメディカルシステムズ)
2019年5月24日(金)〜26日(日)の3日間,日本超音波医学会第92回学術集会など超音波関連の4つの学会・研究会によるUltrasonic Week 2019がグランドプリンスホテル新高輪(東京都港区)を会場に開催された。26日に行われたキヤノンメディカルシステムズ株式会社共催のランチョンセミナー12では,大阪大学大学院医学系研究科/保健学専攻機能診断科学講座の中谷 敏氏が座長を務め,聖マリアンナ医科大学循環器内科の出雲昌樹氏と筑波大学医学医療系臨床検査医学の石津智子氏が,「知っていますか? Aplio i-seriesの魅力〜心エコー編〜」をテーマに講演を行った。
2019年9月号
Ultrasonic Week 2019ランチョンセミナー12 知っていますか? Aplio i-seriesの魅力 〜心エコー編〜
心筋動態を把握し診断に活かす
石津 智子(筑波大学医学医療系臨床検査医学)
本講演では,キヤノンメディカルシステムズの超音波診断装置「Aplio i-series」で使用できる多彩なアプリケーションのうち,心筋動態評価に有用な同社独自のアプリケーション“Smart Fusion”と“3D Wall Motion Tracking”について紹介する。
Smart Fusion
1.概要と臨床的有用性
Smart Fusionは,CT/MRIのボリュームデータを超音波診断装置に取り込み,リアルタイムの超音波画像と連動表示するアプリケーションである。トランスミッタと磁気センサによりプローブ位置を検出し,CT/MRIのボリュームデータと座標を合わせることで,プローブを動かすとエコーの断面と同じCT/MRIの断面が表示される。エコーとCT/MRIの画像を並べた表示(サイドバイサイド表示)や,重ね合わせ表示(ブレンド表示)で評価することができ,マルチモダリティ時代に有用なアプリケーションと言える。
症例1は,小児期に心室中隔欠損(VSD)の手術歴がある40歳代の男性で,肺動脈弁狭窄症(PS)が疑われた。エコーでは,前尖が狭窄しているvalvular PSなのか,右室流出路(RVOT)にヒダ状のものが形成されているためか〔RVOT obstruction(sub-valvular PS)〕の鑑別が難しかった。そこで,CTとのSmart Fusionを行った。エコーのカラードプラ(図1 b)では,RVOTの血流が速いことが確認でき,厚みのある構造物があるように見える。しかし,CT画像(図1 a)では,RVOTに異常な構造物はなく,前尖が肥厚していることが確認できた。また,エコーでは肺動脈内腔がだいぶ狭いように見えるが,CT画像では内腔径がエコーよりも大きいことが確認でき,本症例はvalvular PSと診断できた。
このようにSmart Fusionは,臨床で迅速にエコーとCT/MR画像を合わせて評価できる有用なアプリケーションである。
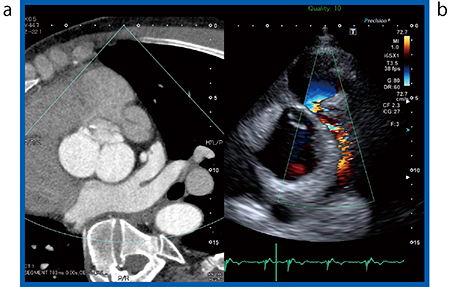
図1 症例1:Valvular PS
2.Smart Fusionを用いた心エコー計測精度の検討
以前から,エコーで計測した左室容積がCT/MRIよりも過小評価となることを疑問に感じていた。そこで,Smart Fusionを用いて,心エコーの計測精度について検討した。
CT/MRIと比べてエコーで左室容積が過小評価となる理由の一つは,2D心エコーでは真の心尖部をとらえられないことが考えられる。Doroszらの報告1)では,2Dエコーと3Dエコーの左室容積をMRIで計測したものと比較すると,拡張末期左室容積(EDV)は2Dで平均48.2mLも過小評価していた。一方,左室全体をとらえられる3Dでは,19.1mLまで過小評価を抑えることができたと報告されている。収縮末期左室容積(ESV)では2Dで27.7mL,3Dで10.1mLと,過小評価の程度が抑えられ,左室駆出率(EF)は2Dで0.1%,3Dで0.6%の誤差で,MRIとほぼ同じ計測結果であった。3D心エコーでは左室容積計測の精度が改善するものの,10〜20mLの過小評価があるとされている。
計測では,2D/3Dのいずれにおいても心内膜を用手的にトレースする。トレースが心内膜をしっかりととらえられているか,Smart FusionのCT画像をリファレンスに検証した。図2で,心内膜をとらえているラインはA〜Cのどれだろうか。演者は従来,Bのラインでトレースすることが多かったが,Smart FusionのCT画像上で心内膜面,心外膜面をトレースしたラインをエコー画像に重ねると,lateral wallのラインがより外側のCのトレースラインが適切であることがわかる(図3)。心室中隔の高エコーは円柱方向の心筋線維配列を描出していると言われるが,本症例では,lateral wallにも高エコー領域(図3←)が認められ,中隔と同様に円柱方向の心筋線維配列を描出していると考えられる。そのため,高エコー領域を挟むようにトレースして計測することで,CTと同じ左室容積の計測が可能になることがわかった。
現在,Smart Fusionを用いた左室容積計測の検証に取り組んでいる。検証では,CTでの容積計測をR-R間隔の75%の静止画で行っている。ある症例の検討では,左室容積は,CTは55mL,従来どおりに計測したエコーは46mLと,エコーでは9mLの過小評価となった。CTをガイドにエコーのトレースラインをより外側に取ると57mLになり,CTと同等の計測結果となった。
Smart Fusionにより,心エコー計測のCTガイドラーニングが可能となり,これが普及すれば検者間誤差の縮小や,多施設研究をより科学的に実施できると考える。
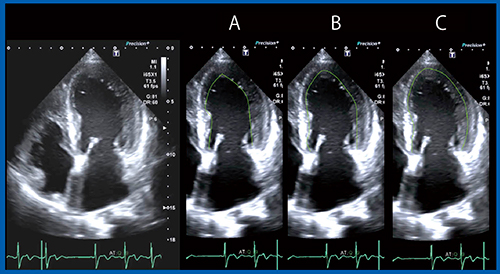
図2 適切な心内膜トレースラインはどれか
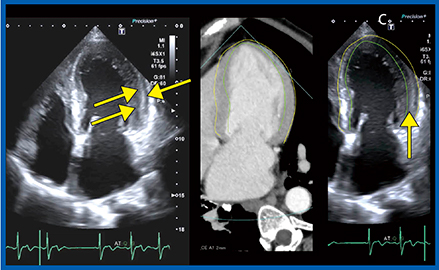
図3 Smart FusionのCT画像をガイドにしたトレースライン
3D Wall Motion Tracking
1.Aplio i-series の独自技術:3D Wall Motion TrackingとActivation Imaging
3D speckle trackingの3D Wall Motion Tracking(3D WMT)は,ボリュームデータを用いて,立方体テンプレートが連続するボリュームをどのように移動するかを三次元的にトラッキングする方法である。2Dで問題となる,表示断面から観察対象が外れるThrough Plane現象が生じず,40vps程度のボリュームレートがあれば十分に評価することができる。3D WMTは,左室用(心房にも適用可能)と右室専用が製品化されている。いずれも十分に検証されており2),3),右室も含めて3D speckle trackingができるというのは,他社にない独自技術である。
さらに,この3D WMT技術を用いた独自の“Activation Imaging”モードを使用することができる。Activation Imagingは,容積とその変化を数値化するだけでなく,電気的興奮と機械的興奮との対応から電気生理検査に近い情報を得ることで,「どこから収縮が始まり,どのように左室全体に伝搬していくか」という経時的変化を,カラーマップで表現することができる。開発では,「CARTO 3システム」(バイオセンス ウェブスター社)の電気生理学的情報と解剖学的情報を統合した3Dマップ(CARTO mapping)などと検証を行い,最適な収縮開始の閾値設定が示されている4)。
2.Activation Imagingの臨床応用
Activation Imagingの臨床応用として,2例紹介する。
1つは心室同期不全5),6)である。典型的な左脚ブロックの拡張型心筋症の場合はあまり威力を発揮しないが,非左脚ブロックなどでリードを留置する位置が難しい症例の場合に非常に役に立った症例も経験した。図4 aに示す心室のActivation Imagingでは,図の左下方から収縮が始まり,図の右上部分へ伝搬していく様子が明瞭にわかる。本症例は体循環心室右室の症例で,非同期(dyssynchrony)が非常に強かったため心臓再同期療法(CRT)適用となり,開胸術により心外膜側からペーシングリードを留置して心室ペーシングを行った。術後のActivation Imagingでは,心臓の同期性が非常に向上したことがわかる(図4 b)。
2つ目の臨床応用例として,WPW症候群を紹介する。WPW症候群は,心房心室間の副伝導路(accessory pathway)で早期興奮が生じ,同部位が先行して収縮する。この動きをActivation Imagingでとらえられるか検証した。WPW症候群のActivation Imaging(図4 c)では,早期に収縮するオレンジ色の部分にaccessory pathwayがあることがわかる。われわれの検討7)では,左室を12分割し,実際にアブレーションした位置とActivation Imagingの示すaccessory pathwayをクロックポジションで比較した。その結果,完全な一致は50%程度であったが,2〜4時方向のように2時間程度の幅をもたせると80%以上一致した。アブレーション後のActivation Imaging(図4 d)では,accessory pathwayの伝搬が弱くなっていることが認められた。
このようにActivation Imagingは,左室の臨床的評価に有用な機能で,個別化医療に非常に役立つ情報を提供でき,治療を最適化することが可能である。
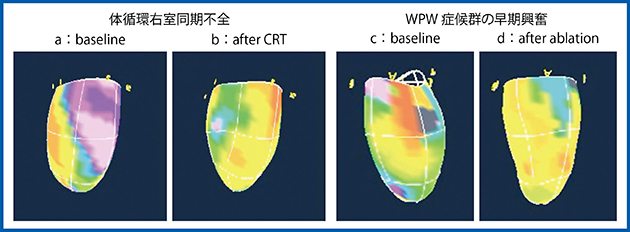
図4 Activation Imagingの臨床応用:体循環右室同期不全5),6)とWPW症候群7)
3.Quad Chamber Tracking
最近は,3D WMT技術を用いた“Quad Chamber Tracking”が可能になった(図5)。Quad Chamber Trackingは,四腔すべてに対して3D speckle trackingを行い,合わせて表示することができ,ボリュームの時間的変化もグラフで示される。
症例2は,ファロー四徴症で小児期にペースメーカーを留置しているが,dyssynchronyが見られたことから,Quad Chamber Trackingを用いて右室と左室の2 chamber表示で評価した。Activation Imagingを重ねて表示すると,RVOTが非常に早期に収縮していることがわかる(図6)。その理由は,心外膜ペーシングでRVOTに心室リードを留置していたためであり,長期経過により壁運動異常を来し,dyssynchronyが生じていることが明らかとなった。本症例はCRTで経静脈的両心室ペーシングを施行した。Quad Chamber TrackingのグラフでCRT前後を比較すると,CRT後は右室のdyssynchronyの興奮が消失しており,左室も完全消失には至らないが良好であった(図7)。2 chamber表示では,適切な位置にリードを留置したことで,壁運動異常が消失していることがわかる(図8)。
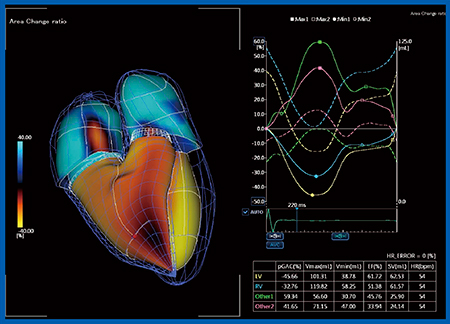
図5 Quad Chamber Tracking
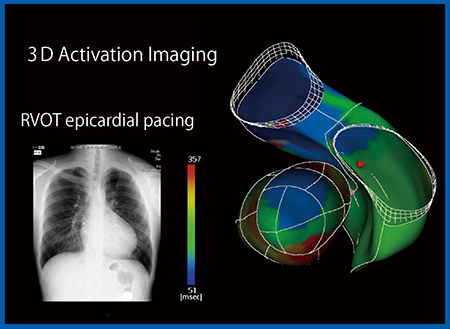
図6 症例2:ファロー四徴症でペースメーカー留置後,長期経過
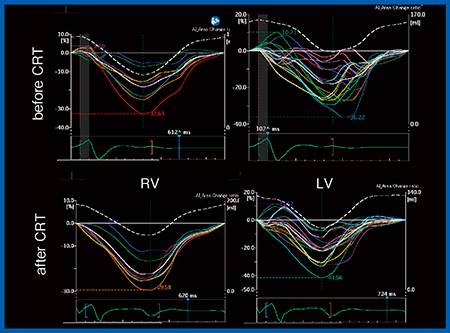
図7 症例2:Quad Chamber Tracking(CRT前後の比較)
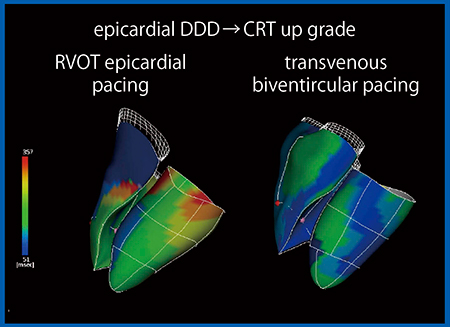
図8 症例2:CRT前後の2 chamber表示
左房リモデリングへのアプローチ
心臓領域では,心房がホットトピックスの一つとなっており,左房リモデリングを非侵襲的に評価し,心房細動に対するカテーテルアブレーションの恩恵を受けられる症例であるかを術前に判断したいという臨床的ニーズがある。
左房リモデリングの進行は,電気的現象としては興奮伝導遅延→低電位,機能・構造的現象としては収縮伝導遅延→リザーバー機能低下・ポンプ機能低下→左房壁肥大→左房拡大,そして組織学的には左房壁線維化の進行として現れる。左房が拡大している場合はカテーテルアブレーションをしても再発率が非常に高いことから,左房リモデリングがあまり進行していない症例に対して積極的にカテーテルアブレーションを行い,洞調律を維持することが有用だとされている。現在は,より早期に左房リモデリングを評価し,治療することが推奨されている。
左房線維化をMRI遅延造影から定量化するという論文が2014年に報告8)され,非常に注目されたが,再現性に乏しく広まってはいない。しかし,このような非侵襲的な評価への臨床的ニーズは非常に高い。われわれは現在,これをエコーで実施できないかと考え,3D WMTを用いて検討を行っている。図9に,持続性心房細動/心房頻拍症例の左房の3D WMTを示す。エコーでは,肺動脈接合部の形状表現は困難であるが,左房の収縮の様子が明瞭にわかる。
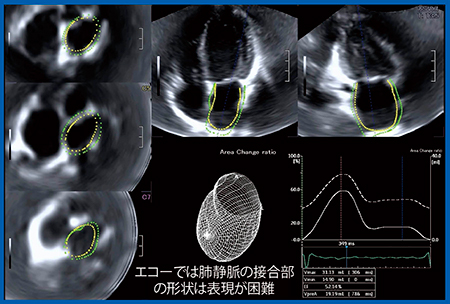
図9 左房の3D WMT
同症例について,CARTO mappingとActivation Imagingでの比較も行った。右房の洞結節(サイナスノード)で発生した電気信号は,心房中隔から左房側に伝わると,一般的に弁輪側,そしてlateral側,anterior側に向かって伝搬するとされているが,CARTO mappingとActivation Imagingのいずれでも,伝搬の様子が明瞭にとらえられている(図10)。また,CARTO mappingによる電気的な左房伝搬時間(LACT)とActivation Imagingによる機械的なLACTを比較したところ,電気的なLACTの方が速いものの,ある程度の相関が確認できた。14症例を対象とした初期検討では,エコーでLACT≦80msの症例はアブレーション後1年の心房細動無再発率は94%であったのに対し,LACT>80msでは55%であった。今後,前向き検討に取り組む予定である。
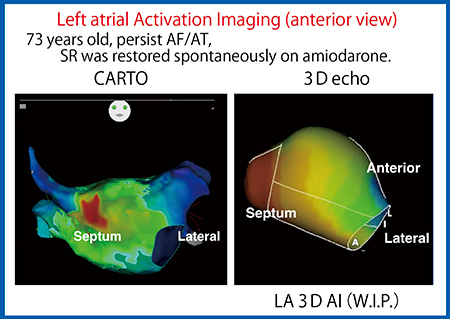
図10 図9の症例のCARTO mappingとActivation Imaging
まとめ
キヤノンメディカルシステムズの独自技術であるSmart Fusionと3D WMTを紹介した。Smart Fusionの活用には臨床医のアイデアが必要であり,3D WMTについても,従来は主観的に評価していたものが数値化できるようになったことで,それをどのように臨床に生かしていくかを検討することが,われわれに課された使命であると考える。これらの技術を,ぜひ日々の診療研究に役立てていただきたい。
●参考文献
1)Dorosz, J.L., et al., J. Am. Coll. Cardiolo. 59・20, 1799〜1808, 2012.
2)Seo, Y., et al., Cire. Cardiovasc. Imaging, 2・6, 451〜459, 2009.
3)Atsumi, A., et al., J. Am. Soc. Echocardiogr., 29・5, 402〜411, 2016.
4)Seo, Y., et al., Circ. J., 77・10, 2481〜2489, 2013.
5)Seo, Y., et al., J. Am. Soc. Echocardiogr., 28・5, 606〜614, 2015.
6)Sugano, A., et al., Can. J. Cardiol., 31・6, 819 e5〜7, 2015.
7)Ishizu, T., et al., Cire. Cardiovasc. Imaging, 9・6, 2016.
8)McGann, C., et al., Circ. Arrhythm. Electrophysiol., 7・1, 23〜30, 2014.

石津 智子(Ishizu Tomoko)
1993年 筑波大学医学専門学群卒業。2000年 同大学院修了。2007年〜筑波大学臨床検査医学講師。2018年〜同病院教授。
