CEST imagingの脳腫瘍への応用
飯田 悦史(山口大学大学院医学系研究科 放射線医学講座)
Session 2 : MR
2020-5-15

当院では,2019年1月から,キヤノンメディカルシステムズ社の「Vantage Galan 3T / ZGO」が稼働を開始し,同年3月よりchemical exchange saturation transfer(CEST)imaging(W.I.P.)の臨床研究を行っている。本講演では,CEST imagingの原理と,キヤノンメディカルシステムズ社のCESTシーケンスの特徴,脳腫瘍への臨床応用について,症例を提示しつつ報告する。
CEST imagingの原理
CEST imagingは,生体内の微量な物質の分布を画像化する手法で,MRIで可能なmolecular imagingの一つであり,従来とは異なるコントラストが得られる機能画像である。CEST imagingでは,対象とする生体内の微量な物質の分子(微量分子)内に含まれているプロトンと生体内に多く存在する水(自由水:bulk water)の間で起こるプロトンの交換現象を利用して間接的に微量分子を画像化する。
具体的には,微量分子に含まれるプロトンに対し特定の周波数のsaturation pulseを印加すると,自由水との間でプロトンの交換現象が起こり,それを繰り返すことで水の信号強度が間接的に低下する。見たい領域に微量分子が含まれていなければ水の信号強度は低下しないため,信号変化を見ることで微量分子の有無を確認可能となる。
APT CEST imaging
1.APT CESTの原理
CEST imagingが対象とする物質はいくつか存在するが,一般的には水信号を0ppmとした場合,+3.5ppm離れた位置にあるアミドプロトンを対象としたamide proton transfer CEST (APT CEST)が用いられることが多い。
APT CESTでは,実際には−6〜+6ppmの周波数帯において約30〜40ポイントでsaturation pulseを印加し,その都度画像データを取得する。
この時,CEST効果による信号変化は5%程度であるため,そのわずかな差を画像から判断するのは困難である。そこで,正と負の周波数(APT CEST Imagingでは±3.5ppm)にsaturation pulseを印加し撮像して得られたデータを差分し,saturation pulseなしで撮像したデータで除したもの(MTRasymmetry:MTRasym)を,マッピングして画像化する(MTRasym_3.5ppm map)。さらに,±3.5ppmにおけるMTRasymの値(MTRasym3.5ppm)として得られるCEST効果で病変を評価する。図1は膠芽腫の症例のMTRasym_3.5ppm mapであるが,右側頭葉の膠芽腫は正常脳実質に比べCEST効果が高いことがわかる。
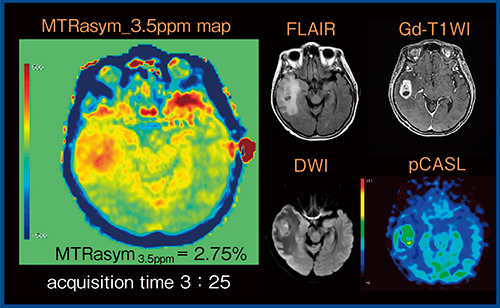
図1 膠芽腫のMTRasym_3.5ppm map(FASE2D)
2.APT CESTの種類と特徴
キヤノンメディカルシステムズ社のAPT CESTには,fast advanced spin echo(FASE)2D,fast field echo(FFE)3D,fast field echo planar imaging(FFEEPI)3Dの3つのシーケンスがある。
FASE2Dは,CESTパルスを1〜2秒印加後にFASE2Dデータの収集を行い,MTRasym mapを作成する。
図1の症例では,病変部のMTRasym3.5ppmは2.75%であった。ただし,2Dでは1枚の画像の収集に3分30秒ほどかかるため,複数枚の画像の取得は現実的ではない。
そこで,3D収集で全脳を撮像することを目的に,FFE3Dが開発された。数十msという短時間のCESTパルスを印加後にFFE3Dでデータ収集を行い,これを繰り返すことでk-spaceを埋めていく。各周波数で同様に実施しMTRasym mapを作成すると,FASE2Dと同様の画像が全脳で得られる(図2)。
図2の症例について2Dと3Dを比較すると,画像に違いは見られないが,3D収集では撮像に9分ほどかかり,撮像時間が長いことが問題であった。そこで,時間短縮を目的にFFEEPI3Dが開発され,2019年7月より当院にて臨床研究が行われている(図3)。FFEEPI3Dで撮像した症例を示す(図4)。右側頭葉の膠芽腫の症例で,全脳を5mmスライス厚で撮像し,30枚ほどの画像が取得できる。撮像時間は4分58秒と,FFE3Dの約半分に短縮され,十分に使用可能な時間となっている。
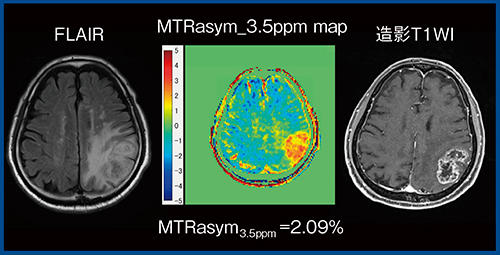
図2 FFE3DによるMTRasym_3.5ppm map(膠芽腫)
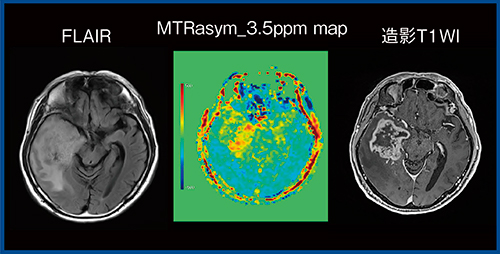
図3 FFEEPI3DによるMTRasym_3.5ppm map(膠芽腫)
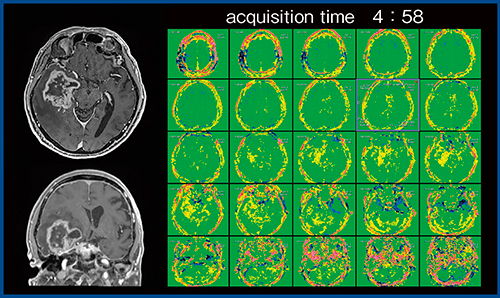
図4 FFEEPI3Dによる全脳の画像(図3と同一症例)
脳腫瘍への臨床応用
CEST imagingの脳腫瘍への臨床応用については,悪性度の評価,病勢評価や治療効果予測,放射線壊死と腫瘍再発の鑑別,神経膠腫IDH-1遺伝子変異の有無との関連などへの活用が報告されている。
Togaoらは,APT CESTによる神経膠腫の悪性度評価について,WHO分類のgradeⅡでは2.1%,gradeⅢでは3.2%,gradeⅣでは4.1%とCEST効果が徐々に高くなるため,low gradeとhigh gradeを明確に区別できると報告している1)。当院の症例でも検討したところ,同様の傾向が見られた。図5は,乏突起神経膠腫(WHO gradeⅡ)のMTRasym_3.5ppm mapであるが,CEST効果は見られず,low grade gliomaとして矛盾しない所見である。
また,Togaoらは,造影MRIにて濃染しない神経膠腫のAPT CESTによる悪性度評価について,拡散強調画像(DWI)のADC値,局所脳血液量(rCBV)と比較したところ,APT CESTのみ,low gradeとhigh gradeを明確に区別できたと報告している2)。
さらに,神経膠腫とリンパ腫の鑑別として,high gradeの神経膠腫の方がCEST効果が高いことが報告されている3)。髄膜腫の良悪性鑑別についても,悪性の異型性髄膜腫の方がCEST効果が高いことが報告されている4)。当院でAPT CEST imagingを実施した3例の髄膜腫(WHO gradeⅠ)においては,1例はCEST効果が低く,2例は高い結果であった(図6)。
膠芽腫治療後のpseudo progressionとtrue progressionにおけるAPT CEST効果の比較では,true progressionでCEST効果が高いことが報告されている5)。
神経膠腫IDH-1遺伝子変異の有無とAPT CESTにおけるCEST効果との関連については,wild typeの方がIDH-1遺伝子変異がある症例よりもCEST効果が高いと報告されている6)。
当院における興味深い症例を1例提示する。本症例(図7)は,FLAIR(a)で左の前頭葉(↑)と頭頂葉(△)の2か所に高信号を呈する腫瘤が認められた。造影MRIでは頭頂葉の病変のみ一部濃染が認められ,より悪性度が高いと思われた。しかし,DWIでは前頭葉の病変の方が高信号でADC値も低く,悪性度が高い印象で,判断に迷う結果であった。頭頂葉の病変は,APT CEST(図7 b)ではCEST効果が高く,メチオニンPET(図7 c)でも高集積であり,前頭葉の病変より悪性度が高いと思われた。病理組織学的検査では,前頭葉の病変は退形成性星細胞腫,頭頂葉の病変は膠芽腫であった。APT CESTでは組織内のタンパクの量がCEST効果に反映されるが,メチオニンPETもタンパクを構成するアミノ酸の一つであるメチオニンの組織内への取り込みを見ているため,脳腫瘍の悪性度の評価において,互いに関連している可能性があると思われた。
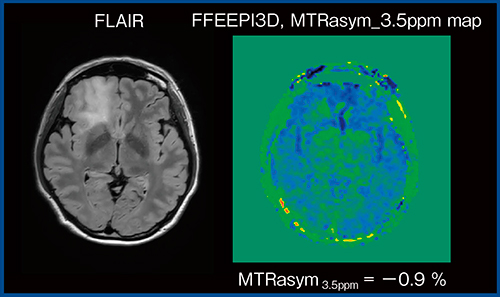
図5 Low grade glioma(WHO gradeⅡ)のMTRasym_3.5ppm map
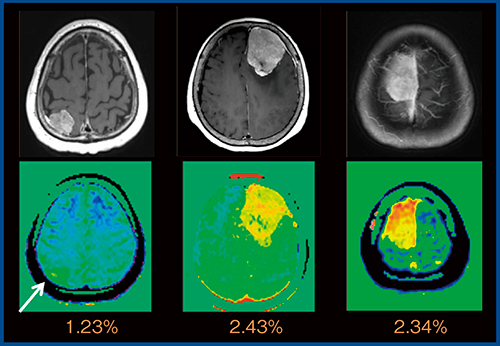
図6 Meningioma(WHO gradeⅠ)のMTRasym_3.5ppm map
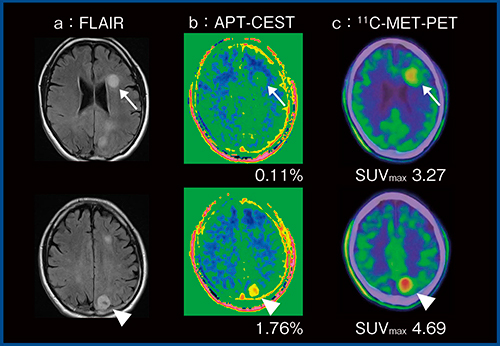
図7 APT CESTによる悪性度評価
まとめ
キヤノンメディカルシステムズ社の3種類のCESTシーケンスのうちFFEEPI3Dは,全脳を5分以内で撮像することが可能である。また,APT CESTは,脳腫瘍の悪性度評価,良悪性鑑別,治療効果判定などでの利用が期待される。
●参考文献
1) Togao, O., et al., Neuro Oncol., 16(3):441-448, 2014.
2) Togao, O., et al., Eur. Radiol., 27(2):578-588, 2017.
3) Jiang, S., et al., Eur. Radiol., 26(1):64-71, 2016.
4) Joo, B., et al., Eur. Radiol., 28(1):331-339, 2018.
5) MA, B., et al., J. Magn. Reson. Imaging, 44(2):456-462, 2016.
6) Jiang, S., et al., Magn. Reson. Med., 78(3):1100-1109, 2017.
- 【関連コンテンツ】
