技術解説(富士フイルムメディカル)
2021年5月号
循環器領域における超音波診断装置の技術の到達点
心不全に対する超音波血流解析法
平野貴史郎[富士フイルムヘルスケア(株)超音波診断事業部超音波マーケティング部]
わが国における新規発症心不全患者は毎年1万人以上の割合で増加しており,心不全パンデミックと言われている。心不全は一度発症すれば予後不良であり,顕性化する前に正確な診断とそれに基づく予防が望まれる1)。「急性・慢性心不全診療ガイドライン(2017年改訂版)」では,心エコー法は心不全診断に最も重要な検査と位置づけられている。本稿では,当社独自の技術による心不全患者に対する血流解析の有用性および展望について述べる。
■“Dual Gate Doppler”による血行動態評価
心エコーにおける血行動態指標のうち,僧帽弁口血流速波形の拡張早期波形E波やE波と僧帽弁輪部の拡張早期波形e’波の比であるE/e’は充満圧の指標であり,心不全診断に有用と言われている2)。当社では,Dual Gate Doppler機能を利用することにより,わずか5秒でE/e’を計測することが可能である。Dual Gate Dopplerは,任意の2か所のドプラ波形を同時に観察することが可能であり(図1),自動的に左室流入路および僧帽弁輪の位置にそれぞれサンプルゲートを設定し,同一心拍でE/e’を計測することが可能である。心不全に関連する心房細動,不整脈のような不規則な心拍の場合には,先々行R-R間隔と先行R-R間隔の比が1に近い区間が計測に適している3),4)。“R-R Navigation機能”は,計測に適した区間を自動で検出し表示することが可能であり,Dual Gate Dopplerと併用することで,拡張機能評価において最も安定した心拍で,再現性の高い計測が可能となり,臨床現場での有用性が期待されている5)〜8)。
また,ASE/EACVIガイドライン9)では,E波とe’波の拡張の開始時間の差(TE-e’)を計測することを推奨している。健常例では,e’波の方がE波よりも早く開始するのに対し,心不全の進行に伴いe’波の開始が遅れ,左房圧の上昇を評価できると報告されている。さらに,TE-e’から肺動脈楔入圧(PAWP)>12mmHgを予測できることが報告されている7)。図2は,経カテーテル大動脈弁留置術(以下,TAVI)前後における拡張のタイミングのズレだが,TAVI前後で僧帽弁口血流速波形には変化がないが,左房圧の減少に伴いTE-e’がTAVI後に短縮することが一目でわかる。TE-e’から左室充満圧と左室弛緩のバランスを加味した拡張機能の評価が可能であり,正確な時間差を計測するためにはDual Gate Dopplerが必要である。
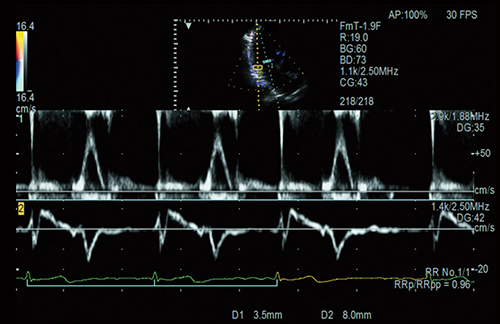
図1 任意の2か所のドプラ波形を同時観察可能なDual Gate Doppler
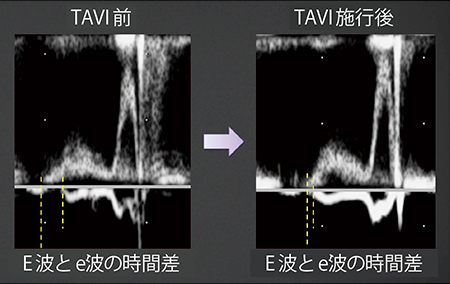
図2 TAVI前後におけるE波とe’波の時間差(TE-e’)
(画像ご提供:筑波大学医学医療系循環器内科学臨床検査医学教授・石津智子先生)
■VFMによる心不全診断の可能性
“Vector Flow Mapping(以下,VFM)”は,血流をベクトル表示によって可視化する技術であり10),血流の効率性や相対圧イメージングが可能である。2020年に発表された米国での研究11)では,心不全患者の重症度に応じた超音波指標の診断精度について人工知能を用いて検証したところ,駆出率(EF)やGlobal Longitudinal Strain(GLS)を抑えて,VFM指標が最重要指標として挙げられた。また,この研究では,超音波指標にVFM指標を加えることにより,心不全重症度分類の正確性が向上すると報告されている。以後,VFM指標について紹介する。
VFMでは,カラードプラ画像を取得することにより,カラードプラによる血流速度情報と2D画像のトラッキング技術による壁運動情報を用いて,容易に心臓・血管内腔の速度ベクトル分布を得ることができ(図3),さまざまな研究により精度,再現性が検証ずみである12)〜14)。
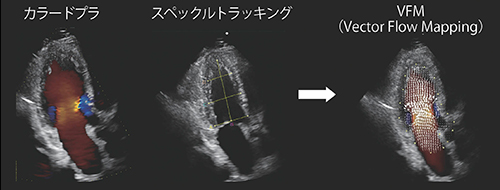
図3 VFMの原理
1.渦度(Vorticity)と循環(Circulation)
渦度(Vorticity)とは,局所での速度ベクトルの旋回の向きと程度を示す。VFMでは,速度ベクトルを縦方向(超音波ビーム方向)と横方向(超音波ビームに垂直な方向)の2つの成分で定義している。演算点近傍の縦方向の速度差と横方向の速度差から渦度を求めることができる。
循環(Circulation)は,閉曲線で囲った範囲に,どちら向きにどの程度の大きさで回転する力がかかっているかを示す指標で,閉曲線上の速度の線積分として表される。また,このCirculationは,閉曲線内の渦度の総和と等しくなる。
VFMでは,フレームごとの渦の外周を自動検出し,渦の中心位置や面積を求めるだけでなく,渦領域内の渦度からCirculationを算出することができる(図4)。心不全例では,等容性収縮期に,正常とは異なり心尖部に渦が検出されることや,左室同期不全例では拡張期に別の渦が形成され,血流が分離する現象も見られる(図5)。渦は流れの効率性を考える上で重要な役割を果たしており,Circulation指標により渦特性の評価が可能である。
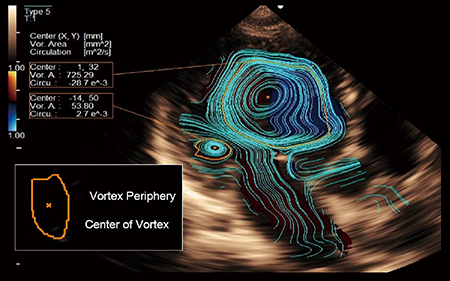
図4 渦特性の計測
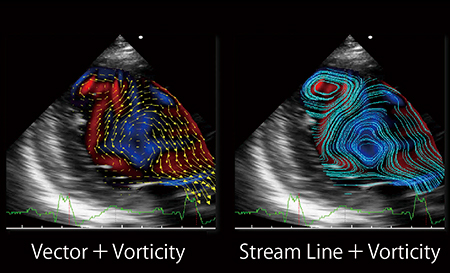
図5 左室同期不全例
心尖部に血流の分離が見られる。
2.相対圧イメージング
断面内の速度分布情報から,ナビエストークスの方程式を用いて心腔内の相対圧分布(Relative Pressure Imaging:RPI)を推定している14)。
断層面内の相対圧表示例を示す(図6)。断層像の中心の赤い点が基準点を示し,その点より圧の低いところを青色系で,圧の高いところを赤色系で表示している。図6 aは拡張早期の時相で僧帽弁側に比べ心尖部側に圧力が低く,これはsuctionが生じていることを示している。図6 bは拡張末期から等容収縮期の時相において,左室中央部に発生する渦では圧が周囲より低圧になっていることを示している。拡張早期の時相では僧帽弁側に比べ心尖部側に圧力が低く,これは左室への能動的血流の吸引を表すsuctionが生じていることを示している。このRPIから推定した拡張早期左室内圧較差(IntraVentricular Pressure Gradient:IVPG)が,健常者と左室駆出率(LVEF)が保たれた心不全である拡張性心不全(HFpEF)患者の区別に応用できることを期待されている。
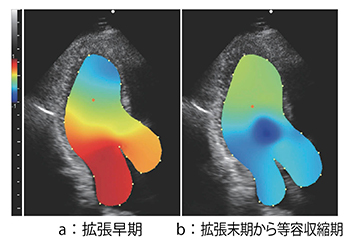
図6 相対圧表示
3.エネルギー損失
血液には粘性があり,乱流などが発生する部位では粘性に伴い摩擦熱を発生する。この摩擦熱エネルギーのことを血流のエネルギー損失と呼んでいる。臨床的には,血管吻合部の狭窄部位や心臓弁の狭窄部位のジェット血流,渦流を主体とする乱流,弁逆流を伴う心臓内の乱流などは速度ベクトルの乱れから高いエネルギー損失を発生する。
◎
当社はDual Gate Doppler機能により,ガイドラインで推奨されている指標を不整脈の症例においても簡便に,再現性良く計測できるようになった。また,VFMは研究ツールであるが,さらなる血行動態に関する研究により,心不全患者の各ステージにおける正確な診断へつながることが期待される。
●参考文献
1) 急性・慢性心不全診療ガイドライン(2017年改訂版). 日本循環器学会/日本心不全学会合同ガイドライン,2018.
2) Nauta, J.F., et al. : Correlation with invasive left ventricular filling pressures and prognostic relevance of the echocardiographic diastolic parameters used in the 2016 ESC heart failure guidelines and in the 2016 ASE/EACVI recommendations : A systematic review in patients with heart failure with preserved ejection fraction. Eur. J. Heart Fail., 20 : 1303-1311, 2018.
3) Tabata, T., Grimm, R A., Greenberg, N L. et al : Assessment of LV systolic function in atrial fibrillation using an index of preceding cardiac cycles. Am. J. Physiol. Heart Circ. Physiol., 281 : H573-580, 2001.
4) 三神大世, 加賀早苗 : 心房細動の心機能は何をどう計るか 心エコー, 7(1): 72-79, 2006.
5) Kusunose, K., Yamada, H., Nishio, S. et al. :
Clinical Utility of Single-Beat E/e’ Obtained by Simultaneous Recording of Flow and Tissue Doppler Velocities in Atrial Fibrillation With Preserved Systolic Function. JACC Cardiovasc. Imaging, 2(10): 1147-1156, 2009.
6) 山田博胤, 他 : Dual Doppler法を使った左室拡張能の評価. Rad Fan, 6(3): 1-4, 2008.
7) Wada, Y., Murata, K., Tanaka, T. et al. : Simultaneous Doppler Tracing of Transmitral Inflow and Mitral Annular Velocity as an Estimate of Elevated Left Ventricular Filling Pressure in Patients With Atrial Fibrillation. Circ. J., 76 : 675-681, 2012.
8) Sugahara, M., Mano ,T., Goda, A. et al. : Prognostic Value of Time Interval Between Mitral and Tricuspid Valve Opening in Patients With Heart Failure. Circ. J., 83 : 401-409, 2019.
9) Nagueh, S.F., et al. : Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography : An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr., 29(4): 277-314, 2016.
10) Itatani, K., Okada, T., Uejima, T., et al. : Intraventricular flow velocity vector visualization based on the continuity equation and measurements of vorticity and wall shear stress. Jpn. J. Appl. Phys., 52 : 07HF16, 2013.
11) Cho, J., Sengupta, P., et al. : A Network-based“Phenomics” Approach for Discovering Patient Subtypes from High-Throughput Cardiac Imaging Data. J. Am. Coll. Cardiol. Cardiovasc. Imaging, 13(8): 1655-1670, 2020.
12) Asami, R., Tanaka, T., et al. : Accuracy and limitations of vector flow mapping : Left ventricular phantom validation using stereo particle image velocimetory. J. Echocardiogr., 15 : 57-66, 2017.
13) Tanaka, T., et al. : A posteriori accuracy estimation of ultrasonic vector-flow mapping (VFM). J. Vis., 20 : 607-623, 2017.
14) Tanaka, T., et al. : Relative pressure imaging in left ventricle using ultrasonic vector flow mapping. Jpn. J. Appl. Phys., 56 : 07JF26, 2017.
●問い合わせ先
富士フイルムヘルスケア株式会社
超音波診断事業部超音波マーケティング部
〒110-0015
東京都台東区東上野2-16-1上野イーストタワー
TEL:03-6284-3004
https://www.fujifilm.com/fhc
