GE Healthcare Japan Edison Seminar 2019
2019年12月号
GE Healthcare Japan Edison Seminar 2019
【MR】腹部MRIの最前線:今後の展望
本杉宇太郎(山梨大学医学部放射線医学講座)

われわれはこれまで,GE社とMRIに関するさまざまな共同研究を行ってきた。本講演では,その一端として,次世代RFコイル技術「AIR Technology」,動脈相の最新の撮像法,人工知能(AI)を活用したdeep learning-based reconstructionについて報告する。
次世代RFコイル技術を採用したAIR Technology
AIR Technologyは,従来のコイル素子とは異なる特殊な細く柔軟なワイヤ「INCAワイヤ」と省電力プリアンプ「e-Modeプリアンプ」を採用した,まったく新しいRFコイル技術である。なかでも体幹部用の「AIR Anterior Array」(AIR AA)は,体幹部撮像において非常に有用なツールであり,以下の3つの特長が挙げられる。
1.65cmのワイドカバレッジ
当院では2018年からAIR Technologyの使用を開始したが,まず驚いたのが,AIR AAだけで65cmという広範囲を撮像できることである。Head Neck Unit(HNU)を組み合わせれば,全身の拡散強調画像(whole body DWI)の撮像も可能である。
2.さまざまなニーズに対応可能
AIR AAは軽量かつ柔軟であるため,脚や腕,肩に巻きつけて撮像でき,全体を一度に描出できる。また,乳児の場合,全身にAIR AAをラップのように巻いて固定できるため,きわめて明瞭な画像を容易に取得可能である(図1)。このように,コイルを密着させられるメリットは非常に大きい。
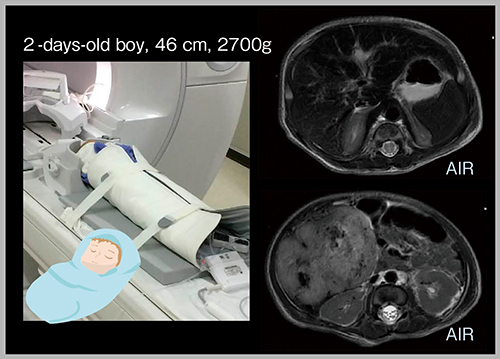
図1 AIR AAの柔軟性を生かした乳児の撮像
3.高いコイル密度によるg-factorの低減と高速化
私は2018年から,American College of Radiology(ACR)の肝細胞がんの診断アルゴリズムであるLI-RADSの編集委員として,肝細胞相で低信号を示す乏血性結節の名称の標準化を提案した(Hepatobiliary Phase Hypointense Nodule without Arterial Phase Hyperenhancement)。乏血性低信号結節は,肝がんの前がん病変,もしくは早期肝がんと呼ばれる病態であり,肝特異性造影剤で描出可能である。微小な病変を確実に描出するために,当院では,肝細胞相は息止めのアキシャルおよびサジタルの“LAVA”(3Dダイナミック撮像法)と,呼吸同期(navigator echo法)のアキシャルLAVAを用いて,それぞれ3.5mm,3.5mm,2mmで撮像していた。しかし,g-factorの低減により高速撮像が可能なAIR AAを用いることで,1.4mmのisotropic画像を息止めで撮像可能となり,一度の高分解能撮像をリフォーマットして診断することが可能となった(図2)。ボクセルサイズが小さいため,従来の方法よりも明瞭かつシャープな画像が得られ,小さな病変も視認できる。
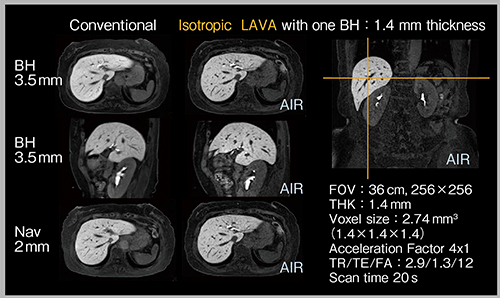
図2 AIR AAを用いた息止めによる乏血性低信号結節の描出
動脈相の最新の撮像法
1.適切な撮像タイミングの取得方法
造影剤投与後のtime intensity curve(TIC)を見ると,動脈相の撮像は,肝実質の造影前,かつ大動脈に造影剤が流入した後が最も適切なタイミングとなる。しかし,心機能の悪化した患者などでは大動脈への造影剤の流入が遅れ,腫瘍が濃染する前に撮像してしまうといったことが起こりうる。これを回避するためには,動脈相を多時相で撮像する方法が有用である。
1)高速撮像(CS & PI)による多時相化
高速撮像法であるparallel imaging(PI)とcompressed sensing(CS)を組み合わせて動脈相に用いることで,従来の1相分の撮像時間(16秒)と同等の18秒で3相(1相6秒)の多時相撮像が可能となる。
図3は腎細胞がん(RCC)膵転移症例の動脈相の画像であるが,3相目(c)では描出されない微小な転移が,膵実質が濃染される前の1相目(早期動脈相:a)では確認できる。患者ごとに適切な動脈相のタイミングが異なるため,多時相撮像はきわめて有用である。
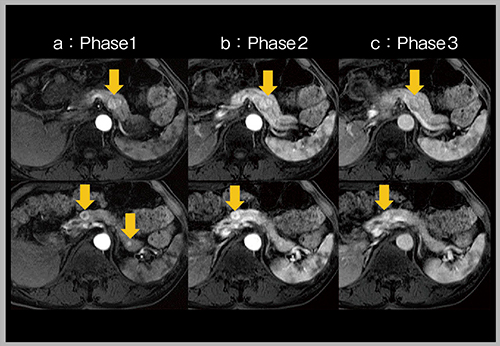
図3 高速撮像による動脈相の多時相化(RCC膵転移)(W.I.P.)
2)View sharingによる多時相化
“DISCO”は,view sharingを併用した技術で,k-spaceの中心を頻回に撮像することで多時相化する手法である。DISCOを用いれば,1回の息止めで多数の時相を取得できる。
肝細胞がん(HCC)は動脈相で濃染し,門脈相から遅延相にかけてwash-outするが,その際,辺縁部にリング状の濃染,すなわちenhancing capsuleを呈する。enhancing capsuleは,LI-RADSでは主要項目であり,HCC診断の確信度が向上するとされている。HCCの精査のため当院に紹介された2症例について,DISCOを用いて6相で撮像した動脈相の画像(図4)を見ると,a(87歳,女性,C型肝炎)は最初に全体が濃染し,その後にリング状となる典型的なHCCのパターン,b(72歳,男性,C型肝硬変)は最初からリング状に濃染し,内部が壊死したパターンを呈していた。このように多時相を取得することで,腫瘍の血行動態をより詳細に検討することができる。
一方,日本で多用される肝特異性造影剤は,肝実質に急速に取り込まれるためenhancing capsuleが不明瞭となり,しばしば描出されない。そこで,門脈相よりも前の後期動脈相であれば,enhancing capsuleをより高頻度にとらえられると考えた。実際の178症例で検討したところ,門脈相のみでLI-RADSのクライテリアのLR-5(ほとんどすべてがHCC)に分類できたのは90症例であったが,動脈相の6相で評価したところ95症例となり,HCC診断の確信度が向上する結果となった1)。
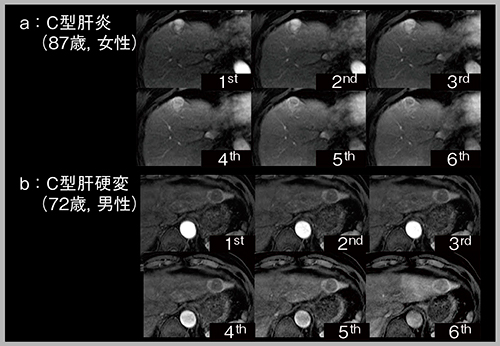
図4 View sharing(DISCO)による動脈相の多時相化(HCC精査)
2.呼吸性のアーチファクトへの対応
息止め不良の患者に対しては,自由呼吸下での動脈相の撮像が有用である。
1)Navigator echo法
DISCOにnavigator echo法を併用して,呼気のデータのみを収集することで,自由呼吸下での動脈相の撮像が可能となる2)。図5は腎腫瘍のある13か月,男児の症例であるが,呼気のデータのみを用いて画像再構成することで,腫瘍の細かい隔壁まで良好に描出された。
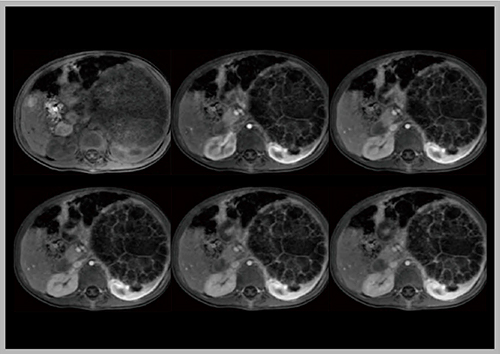
図5 Navigator echo法併用のDISCOによる自由呼吸下での動脈相の撮像(腎腫瘍)
2)Stack-of-stars acquisition
stack-of-stars acquisitionはradial scanであり,動きに強いことが大きな特長であるが,さらに2つのアドバンテージがある。1つは,k-space中心のデータが均一にサンプリングされているため,どの部分を取っても再構成可能であり,例えば1つの画像を複数に分けて,後から時間分解能を変更できる。2つ目は,収集されたデータはボリューム全体の信号を有しており,それをプロットすると呼吸の動きが可視化できる。呼気のデータのみに重み付けして再構成すれば,呼吸性アーチファクトを低減するsoft gatingが可能である。この2つを組み合わせたsoft gated retrospective multiple phasesによって,navigator echo法を使用することなく,自由呼吸下でのダイナミックMR撮像が可能となる。
実際に動脈相の撮像を行うと,2分間で5相(1相あたり24秒)の画像が得られ(図6),必要であれば各画像を2つに分けて10相(1相あたり12.6秒)の画像にすることもできる。さらに,view sharingを併用すれば,1相あたり0.5秒で再構成した,明瞭かつ血管撮影に匹敵する高時間分解能な画像が得られ,非常に滑らかなTICも作成できる。
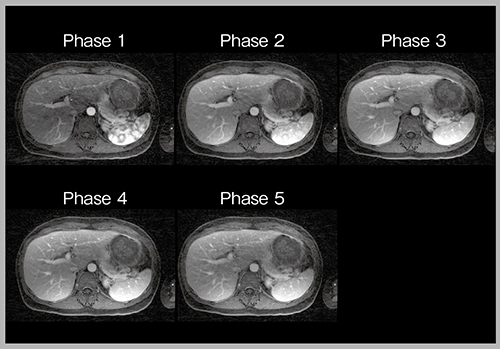
図6 Stack-of-stars acquisitionによる自由呼吸下での動脈相の画像(W.I.P.)
Deep learning-based reconstruction
MRIにおけるAIの応用として,最も期待され,最も臨床応用に近い技術は,deep learningによるノイズ除去(画質改善)であると考える。
図7は脂肪抑制のT2強調画像で,aは当院のルーチンの画像,bは面内の空間分解能を少し向上し,cはbよりもさらにスライス厚を半分にしている。図7のc(上)はSNRの低下が著しいが,deep learningでノイズ除去を行ったc(下)はaのルーチン画像と遜色のないSNRが得られる。
さらに,われわれは呼吸性のアーチファクトのパターンをdeep learningに学習させ,アーチファクトのある画像からアーチファクトのみを差分することで,明瞭な画像を取得する“Motion Artifact Reduction with Convolutional Neural Network”(MARC)を開発した3)。こうした手法も相まって,今後,MRIの画像は飛躍的に向上していくと思われる。
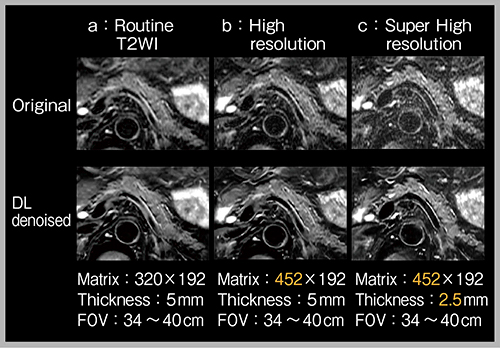
図7 Deep learningによるノイズ除去(W.I.P.)
●参考文献
1)Ichikawa, S., Motosugi, U., et al., Invest. Radiol., 53・4, 191〜199, 2018.
2)Yoruk, U., et al., Magn. Reson. Med., 75・3, 1301〜1311, 2016.
3)Tamada, D., et al., Magn. Reson. Med. Sci., 2019(Epub ahead of print).
- 【関連コンテンツ】
