技術解説(フィリップス・ジャパン)
2020年5月号
腹部領域におけるCT技術の最新動向
いつでも使えるスペクトラルイメージング ─腹部領域─
鈴木志津馬[(株)フィリップス・ジャパン プレシジョンダイアグノシス事業部CTモダリティセールススペシャリスト]
フィリップスでは,2016年4月より,二層検出器技術を搭載した「IQon Spectral CT」を販売開始した。この装置は,“全検査のレトロスペクティブなスペクトラル解析”を可能とするCT装置である。本装置では120kVpのX線エネルギーを照射して,さまざまな画像を作成できるデータセットをアウトプットする。これを“Spectral Based Image(以下,SBI)”と呼び,レトロスペクティブ(プロスペクティブも可)に使用して,仮想単色X線画像(以下,MonoE),ヨード密度画像(以下,Iodine no Water),実効原子番号画像(以下,Z effective)など,“Spectral Result”という画像へ派生させる。
本装置は,120kVpのX線エネルギーを二層検出器で分光する技術のため,120kVp画像は従来どおり作成される。つまり,120kVp画像の診断とスペクトラル画像の診断の選択も行うことができるのである。さらに,検出器によるエネルギー分光方式を採用することで,データの空間的・時間的ミスレジストレーションが発生しないという点も特長である。
近年,スペクトラルイメージの臨床における有用性は国内外で多く報告1),2)されている。本稿では,腹部領域におけるスペクトラルイメージの有用性,汎用性について解説する。
●SBIの生成方法
IQon Spectral CTの最も重要な技術が,二層検出器「NanoPanel Prism」である。NanoPanel Prismは,上層のシンチレータはYttrium(低エネルギーデータ収集),下層はGOS(高エネルギーデータ収集)で構成されている。また,極薄フォトダイオードをそれぞれのシンチレータに側面配置させることで,1つの連続X線を高低2つのエネルギーデータとして分光・収集する検出器である。
120kVpのX線エネルギーがNanoPanel Prismへ入射し,エネルギーデータを分光する。高・低エネルギー帯の2つのサイノグラムは,それぞれ光電効果データ,コンプトン散乱データへと分配される。その後,光電効果データ,コンプトン散乱データ同士で結合することで,光電効果画像,コンプトン効果画像を作成する。
もう一方で,NanoPanel Prismで取得された2つのエネルギーデータをそのまま再構成して,conventional HU画像を作成する。conventional HU画像とは,120kVpの管電圧で取得した従来画像である(以下,120kVp画像)。そのため,逐次近似応用画像再構成である“iDose4”,逐次近似画像再構成法である“IMR Platinum”,および金属アーチファクト低減技術である“O-MAR”も使用可能である。
上記で作成された光電効果画像,コンプトン散乱画像,120kVp画像の3つのデータを集約することで,SBIが完成する(図1)3)。このSBIは,CTコンソールから直接Spectral Resultを出力が可能であり,かつフィリップスのサーバ型ワークステーション「IntelliSpace Portal」内で,瞬時にさまざまなスペクトラルイメージとして画像展開をすることも可能となっている。
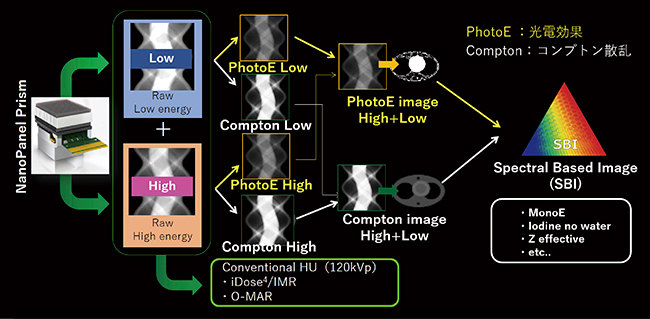
図1 NanoPanel PrismからSBIまでの再構成のフロー
●腹部領域のMonoE
MonoEは,Spectral Resultの中でも使用頻度が最も高い画像である。その理由は,MonoEは,実効エネルギーレンジを40〜200keVと広範囲で持っており,70keV画像を120kVp画像と同じCT値になる基準画像として,70keV以下では120kVp画像と比較してヨード造影剤,脂肪などのコントラストを強調し,100keV以上になるとビームハードニングを低減することができるためである。特に,低いエネルギー帯ではヨード造影のCT値を任意に強調できるため,臨床応用の幅は広い。
しかしながら,一般的なdual energy CTでは,実効エネルギーが低いほど,あるいは高いほど画像ノイズの増加が顕著になり,その画質の劣化に比例して臨床での使用頻度が低くなるのが現状であった。この画像ノイズはanti-correlated noiseと呼ばれ,現在のdual energy CTの臨床応用の大きな妨げとなっている4)。そこで,IQon Spectral CTでは,画像再構成時にanti-correlated noiseを低減する処理を施し,全エネルギー帯の画像ノイズの変化を大幅に低減し,MonoEによる高コントラストかつ低ノイズ画像を実現した5)。
図2で示す症例は,結腸がん術後の造影CT検査である。IQon Spectral CTは,体幹部撮影で必須になるCT-AEC(自動露出機構)を併用した高速撮影(ヘリカルピッチ制限なし)が行えるため,広範囲の撮影が可能である。まず,この症例では,120kVp画像で肝臓辺縁の不整形による転移が疑われた(図2 a)。しかしながら,造影効果がなく,さらなる診断情報が必要とされた。そこで,レトロスペクティブにMonoEで確認すると,造影効果が増強され(図2 b),診断確度を向上させた結果となった。
また,MonoEの造影剤増強効果により,造影剤を減量した検査も実施可能である6)。さまざまな理由により腎機能が低下した患者に対して,造影剤低減検査の有用性は大きいと考える。
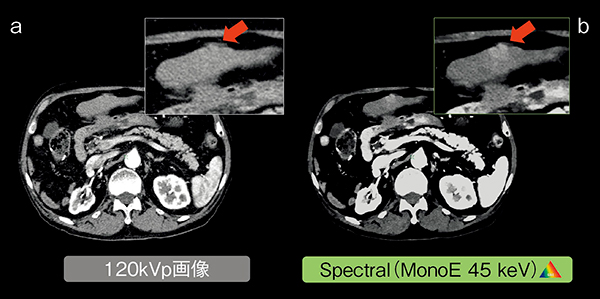
図2 肝転移症例
a:120kVp画像
b:MonoE(45keV)
●腹部領域のIodine no Water
ヨード密度画像Iodine no Waterは,ヨード造影剤を定量値(mg/mL)で表記することができ,PACS内でも定量値(mg/mL)を確認することができる。さらには,その定量値でカラーマップ表示が可能となる。つまり,グレースケール表記のCT値と比較すると,ヨード造影剤の大幅な視認性の向上が期待される。
図3では,120kVp画像において腸管虚血が疑われた。また,腸管膜動脈などの血栓は確認できていない。そこで,Iodine no Waterで確認したところ,明らかな血流低下部位(図3 b)が見られ,最終的に非閉塞性腸管虚血症と診断された。このように,CT値だけでは判断し難い症例の診断価値の向上が期待されている。
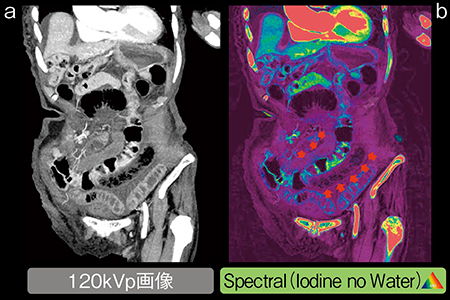
図3 非閉塞性腸管虚血症例
a:120kVp画像
b:120kVp画像とIodine no Waterのフュージョン画像
●腹部領域のZ effective
Z effectiveは,複数の元素で構成されている物質の平均的な原子番号を算出した画像であり,カラースケールで表記される。そのため,120kVp画像で同じCT値として表記される物質を,異なる実効原子番号として物質弁別する際に使用される。実効原子番号は,水は7.4,脂肪は5.9など,既知の数値が発表されている。また,先述したMonoEと併用することで,X線陰影物質を明らかにすることが期待されている。
図4では,心窩部痛の原因精査で,冠動脈・大動脈・肺塞栓のルールアウトの撮影範囲を上腹部まで広げて撮影した。冠動脈,胸部では異常は指摘されなかったが,胆囊拡張が見られた(図4 b)。Z effectiveで確認をしたところ,胆囊内に明らかな胆汁以外の物質の存在を確認した(図4 a)。HU Attenuation Plotで各実効エネルギーのCT値の変動を見ると,脂肪組織と同様の変動になっており,コレステロール結石と診断された(図4 c, d)。このコレステロール結石は,120kVp画像(MonoEでは,70keVで近いCT値になる)では胆汁と見分けがつかないX線陰影結石として現れる場合がある。Z effectiveやMonoEを診断補助として使用することで,診断時間の短縮へつながることが予測される。
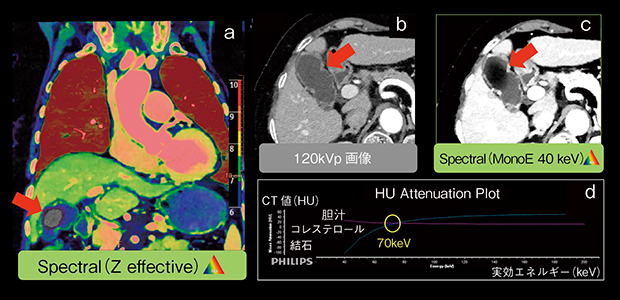
図4 コレステロール結石症例
a:Z effective
b:120kVp画像
c:MonoE
d:HU Attenuation Plot(縦軸:CT値,横軸:実効エネルギー)
◎
本稿では,スペクトラルイメージの有用性・汎用性について紹介した。このスペクトラルイメージをレトロスペクティブに解析することで,臨床現場での応用の場がさらに広がっていくと考える。今後は,これらの画像が臨床現場では見慣れない画像,あるいは特別な画像として扱われるのではなく,臨床現場に近く,医療従事者が触れやすい存在になることを期待したい。
●参考文献
1) Ma, Q., et al. : Dual-layer detector spectral CT versus magnetic resonance imaging for the assessment of iron overload in myelodysplastic syndromes and aplastic anemia. Jpn. J. Radiol., 38 : 374-381, 2020.
2) Neuhaus, V., et al. : Bone marrow edema in trauma vertebral compression fractures : Diagnostic accuracy of dual-layer detector CT using calcium suppressed images. Eur. J. Radiol., 105 : 216-220, 2018.
3) Rassouli, N., Etesami, M., et al. : Detector-based spectral CT with a novel dual-layer technology : Principles and applications. Insights Imaging, 8 : 589-598, 2017.
4) Kalender, W.A., Klotz, E., Kostaridou, L. : An algorithm for noise suppression in dual energy CT material density images. IEEE Trans. Med. Imaging, 7(3): 218–224, 1988.
5) Ozguner, O., Dhanantwari, A., et al. : Objective image characterization of a spectral CT scanner with dual-layer detector. Phys. Med. Biol., 63 : 025027, 2018.
6) Nagayama, Y., et al. : Dual-layer DECT for multiphasic hepatic CT with 50 percent iodine load : A matched-pair comparison with a 120kVp protocol. Eur. Radiol., 28 : 1719-1730, 2018.
●問い合わせ先
株式会社フィリップス・ジャパン
〒108-8507
東京都港区港南2-13-37 フィリップスビル
フリーダイアル:0120-556-494
【フィリップスお客様窓口】
土日祝休日を除く9:00〜18:00
www.philips.co.jp/healthcare
