New Horizon of 4D Imaging(ザイオソフト)
2016年3月号
Ziostation2による心筋ダイナミック血流解析の臨床利用
佐藤英幸(社会福祉法人仁生社 江戸川病院放射線科)
CTの進化は著しく、多列化・高速化・高分解能化は多くの領域に恩恵をもたらした。特に循環器領域では、CTを用いた冠動脈評価(coronary CT angiography:CCTA)が一般的に行われるようになっており、冠動脈造影(coronary angiography:CAG)に劣らない評価が可能になってきている1)。冠動脈の狭窄率評価が重要であることに疑う余地はないが、心筋の虚血評価はその後の治療方針決定、バイアビリティ評価に大きくかかわってくる。虚血評価は核医学が得意とする分野ではあるが、CTで虚血の評価も可能になれば、冠動脈、心筋の両方を一度に検査することができ、その有用性は高いと思われる。本稿では、Ziostation2のCT心筋ダイナミック血流解析を用いたCCTA+心筋Perfusionについて述べる。
虚血性心疾患の画像診断について
虚血性心疾患(ischemic heart disease:IHD)の画像診断には、患者の臨床的背景や心電図などの検査からリスク層別化され、高リスク群には治療を見据えたCAGを優先し、中等度リスク群と判断されたものに対しCCTAによる冠動脈の形態評価、そして心筋シンチグラフィなどを用いた機能評価へと推奨2)されている。
CCTAによる形態評価は、主に優位病変を見つけることを目的とし、併せてプラーク評価3)なども可能である。しかし、形態評価のみでは治療効果の予測が不十分であり、心筋虚血の評価が重要とされている。虚血評価においては冠血流予備比(fractional flow reserve:FFR)による虚血評価が循環器内科医からの信頼も高く、ゴールドスタンダードになりつつあるが、CAGと同様に侵襲的なカテーテル検査になることから患者負担が大きくなってしまう。非侵襲的な検査による虚血評価には、心筋シンチグラフィがありエビデンスも豊富にそろっていることから、確立している検査と言えるが、分解能が低く多枝病変や内膜側優位な虚血の評価などが困難であるなどの問題もある。
そこで、CTやMRIを用いた心筋Perfusionによる虚血評価が近年では多数報告4),5)されており、分解能がシンチグラフィよりも高いことから、多枝病変や内膜/外膜の評価なども可能とされている。さらにCTを用いたときの最大のメリットとしては、すでに確立している冠動脈の形態評価と同時評価できるという点である。
心筋虚血と心筋ダイナミック血流解析
心臓に存在する動脈は、CAGやCCTAで評価している冠動脈と、心筋内に張り巡らされている細動脈、さらに毛細血管に分けることができる。本来、冠動脈に狭窄がなく心筋への血流が正常な場合、心筋内に存在する細動脈は最大拡張しておらず、基本的には予備能を保っている。しかし、冠動脈に狭窄が起こるなどして心筋への血流が減少すると、病変部よりも末梢側の細動脈が拡張し総血液量を保とうとする。この状態は安静時で表現でき、心筋評価を行っても病変部と正常部でのコントラストはあまりない(梗塞領域は低下)。
しかし、運動負荷や薬剤負荷を行うことで、非病変領域の細動脈が拡張し血液量が増えると、すでに予備能を使っている病変部では負荷を行っても血液量がそれ以上増えることはないため、正常部と病変部にコントラストが生まれる。また、冠動脈から細動脈に血液が供給される際、心筋外膜側から心筋内膜側に向けて血液を供給していくため、虚血や梗塞は心筋内膜側で優位に観測されることとなる。この虚血の機序を反映し、心筋血流をCTで画像化するためには、造影剤を投与し経時的に心臓全体を撮影することで、心筋へのファーストパスをとらえ、心筋血流を定量・定性評価することが可能になる(図1)。
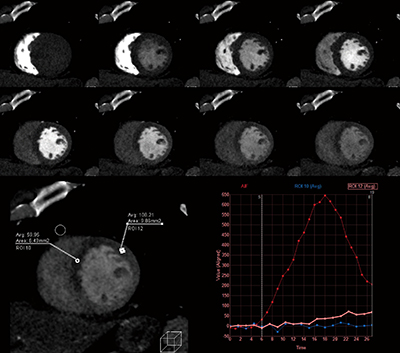
図1 心筋Dynamic Perfusion
複数心拍を撮影し解析を行っていくことになるが、同一心位相をターゲットに撮影したとしても心拍の変動や心臓の生理的な動きにより、多少のズレが生じてしまうことが知られており、Perfusionの解析においても問題となってしまう。この問題に対しZiostation2の「CT心筋ダイナミック血流解析」では、最初に撮影したすべての時相に対し非剛体位置合わせを行い、位置ズレを補正してから解析することが可能であり、定量評価を行う上では重要であると考える。心筋ダイナミック血流解析ではmaximum slope法を用いた血流量(blood flow:BF)と、area under the curveから得られる血液量(blood volume:BV)が取得可能である(図2)。また、得られたデータをCCTAの画像にフュージョンすることも可能で位置ズレのないCCTA+心筋評価が任意方向から観察可能である(図3、4)。
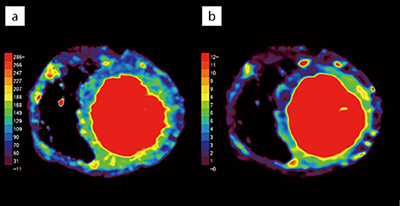
図2 心筋ダイナミック血流解析による結果表示
a:BF、b:BV。図1の患者であり、BF・BVともに前壁中隔に低下を認める。
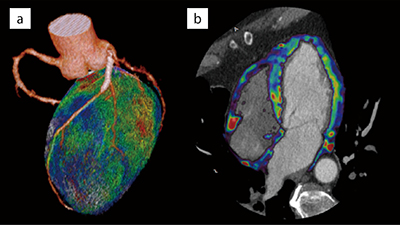
図3 Ziostation2でのCCTAとBVのフュージョン画像
a:3D画像、b:2D画像(4Chamber View)
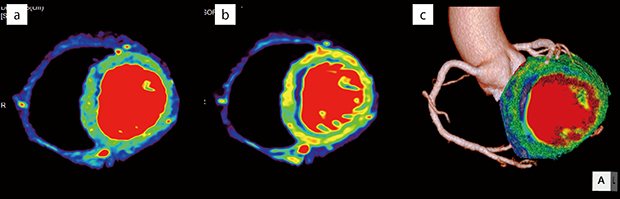
図4 LAD#6にAMIを呈し中隔の内膜側梗塞を疑う症例
a:BF、b:BV、c:CCTAとBVのフュージョン
BFでは前壁中隔に内膜側優位の低下を認めるが、BVではより下壁側まで広範囲に低下しているのがわかる。
撮影プロトコール
当院では、「Revolution CT」(256列MDCT、GE社製)を使用し心筋Perfusionを行っているが、160mmカバレッジがあれば、ほぼすべての患者で心臓全体をカバーすることができる。また、3Dグリッドやmulti material artifact reduction(MMAR)といった最新技術が搭載されており、低線量でもアーチファクトが少なく撮影できることは、Perfusionにおいて大きなアドバンテージとなっている。撮影の流れは、最初に負荷心筋Perfusionを行い、その後安静時の心筋Perfusion、そしてCCTAと遅延造影を行っている。撮影条件は80kVp、250mA、0.28s、ASiR-V70%でPerfusionを行っているが、Revolution CTには70kVpも備わっており、今後検討していく必要があると考える。
また、Perfusionを行う時には、撮影を始めるタイミングと撮影時間が重要になる。当院が行った検討では、大動脈に造影剤が到達する時間は平均12秒で、最短10秒であった。そこで当院では10秒を撮影開始としている。撮影時間に関してはMRIのPerfusion画像を用いて、造影剤が左室に到達してから心筋にたどり着くまでの時間を測定したところ、タイムラグは約3秒であった。造影剤の注入時間は10秒に設定しているため、当院の検討と造影理論を考慮すると20秒あれば十分ということになるが、現在検討段階ということもあり25秒程度に設定している。また、この時間は患者の息止め時間でもあるため、事前の練習を十分に行い、患者に検査内容を理解してもらうことに努めるとともに、当院では撮影の途中で息が抜けていかないように鼻栓をして検査を行っている。
今後の課題
心筋Perfusionにおける問題の1つに被ばくがある。当院では前述した撮影プロトコールを用い、現在Perfusionが4mSv、CCTAが1mSv、遅延造影が0.5mSvと、すべて行っても10mSv未満になることを目標にしている。近年では、CT装置では逐次近似再構成法が応用されてきており、Ziostation2ではPhyZiodynamicsという補完処理がある。どちらもノイズ低減効果をもたらすが、これらの技術を有効活用することで今後さらなる被ばく低減が期待できる。
現在のところ、心筋Perfusionを用いた心筋評価については、まだエビデンスも少なく一般的な検査とは言い難い。しかし、CT装置とワークステーション双方の技術向上と虚血評価の重要性が問われる今日の循環器領域では、非侵襲的に評価できるメリットは大きい。当院でも撮影のプロトコールや画像所見については試行錯誤中であるが、より多くの施設で今後心筋評価も行っていただき、臨床に役立つ検査として確立できれば幸いである。
[参考文献]
1)Hamon, M., et al. : Coronary arteries ; Diagnostic performance of 16- versus 64-section spiral CT compared with invasive coronary angiography. Meta-analysis. Radiology, 245・2, 720〜731, 2007.
2)山科 章・他 : 冠動脈病変の非侵襲的診断法に関するガイドライン. Circulation J., 73(Suppl.Ⅲ), 1091〜1114, 2009.
3)Motoyama, S., et al. : Plaque characterization by coronary computed tomography angiography and likelihood of acute coronary events in Mid-Term Follow-Up. J. Am. Coll. Cardiol., 66, 337〜346, 2015.
4)Rochitte, R.T., et al. : Computed tomography angiography and perfusion to assess coronary artery stenosis causing perfusion defects by single photon emission computed tomography. the CORE320 study. Eur. Heart J., 35, 1120〜1130, 2014.
5)Koo, H.J., et al. : CT-based myocardial ischemia evaluation ; Quantitative angiography, transluminal attenuation gradient, myocardial perfusion, and CT-derived fractional flow reserve. Int. J. Cardiovasc. Imaging, 2015(Epub ahead of print).
