Zio Vision 画像の本質を診る(ザイオソフト)
第13回呼吸機能イメージング研究会学術集会が,2022年1月21日(金),22日(土)にアクロス福岡(福岡市中央区)で開催された。学会共催ランチョンセミナー1(ザイオソフト株式会社 / アミン株式会社)では,藪内英剛氏(九州大学大学院医学研究院保健学部門)が座長を務め,岩澤多恵氏(神奈川県立循環器呼吸器病センター放射線科)が講演した。
2022年4月号
第13回呼吸機能イメージング研究会学術集会ランチョンセミナー1
定量化で見えてくる呼吸器疾患の病態
岩澤 多恵(神奈川県立循環器呼吸器病センター放射線科)
本講演では,呼吸器疾患の定量化について,リウマチ肺の気道病変(AWV% rl),間質性肺炎の病変の広がり(QZIP-ILD),間質性肺炎の進行に伴う肺のゆがみ(移動量)を報告する。
リウマチ肺の気道病変の定量化(AWV% rl)
関節リウマチにおいて,肺病変は患者の生命予後に関連する重要な因子となっている。リウマチ肺では,間質性肺炎に加えて,多彩な気道病変が見られることが知られ,気管支拡張と閉塞性気管支炎という,一見相反する病変が同一症例内に混在する。蛇澤らは,病理学的に膜性細気管支レベルを中心に,気管支壁への細胞浸潤を伴う破壊性細気管支炎が起こり,中枢側の気管支には気管支拡張が見られたと報告している1)。
当センターの高精細CT「Aquilion Precision」(キヤノンメディカルシステムズ社製)の1024×1024・0.25mm厚の高精細画像では,従来の3D画像では描出が難しかった,末梢の気管支拡張についても3D画像で観察可能である(図1)。図1 bのようにリウマチ肺では比較的軽症の症例でも,末梢に囊胞状の気管支拡張が観察される。広範囲に間質性肺炎が広がる症例では,中枢側の気道にも気管支拡張が見られる(図1 e)。また,間質性肺炎が認められない症例で,気道病変が見られることもしばしばあり,リウマチ肺において気道病変を定量化することは病態把握に重要と考えられる。
気管支の定量評価について,COPDの領域では多数の業績が報告されている。気管支1本1本について,気管支内腔と気管支壁の面積比を求める手法(WA%)2),気管支全体の内腔体積を算出し肺の体積に対する気管支内腔の体積の割合を求める手法(AWV%)3)などがある。われわれは,このAWV%を応用し,心拍の影響の少ない右下葉を対象として,ザイオソフト社の「Ziostation2」を用いて,Aquilion Precisionで撮影した1024×1024の画像で気管支内腔の評価を行い,同時に体積と間質性肺炎の病変の広がりを計測(後述のQZIP-ILDを使用)し定量化した(AWV% rl)。
図1に解析結果を示す。症例上(a〜c)は50歳代,女性,症例下(d〜f)は70歳代,男性で,いずれも関節リウマチと診断されている。気管支3D画像で見ると,症例上にも軽微な気管支拡張があり(図1 b),症例下では気管支拡張が高度であった(図1 e)。AWV% rlは,症例上が2.19%,症例下が5.22%であった。
当センターの小口らが,リウマチ肺の症例で第5次から第7次の末梢気管支の内腔面積を測定し,AWV% rlと比較したところ,両者の間に有意な相関が見られた。AWV% rlは気管支拡張の指標となりうる可能性が示された。また,AWV% rlは呼吸機能検査やKL-6とも相関が高く,間質性肺炎の病変の広がりとも高い相関を示した4)。AWV% rlは,リウマチ肺における気道病変の定量評価法として有用であると考えられる。
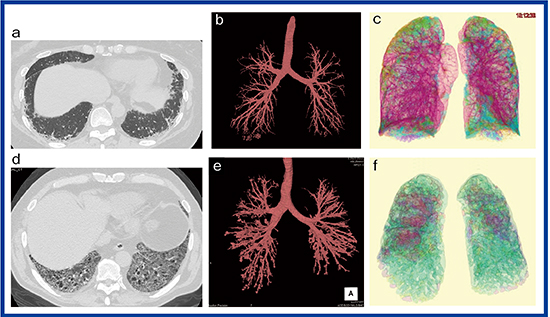
図1 リウマチ肺のCT所見とその解析結果
症例上(a〜c) 50歳代,女性,病変のextent:19.2%,AWV% rl:2.19%
症例下(d〜f) 70歳代,男性,病変のextent:84.1%,AWV% rl:5.22%
a, d:1024×1024・0.25mm厚の高精細CT画像
b, e:高精細CTから作成した気管支3D画像 c, f:QZIP-ILDの解析結果(3D表示)
間質性肺炎の病変の広がり(QZIP-ILD)
間質性肺炎の定量評価にはさまざまな手法があるが5),6),われわれも横浜国立大学と共同で“GHNC(Gaussian histogram normalized correlation segmentation)システム”を開発した7)。GHNCシステムは,CT値と微分画像の画素値の2つのパラメータを使うシンプルな手法で,CTメーカーや再構成関数を問わず解析できる特徴がある。現在,当センターが主幹となっている間質性肺炎の前向きレジストリー研究(JIPSレジストリー)でも用いられている。ただ,GHNCは完全な自動解析ではなく,1症例15分程度時間がかかるという問題があった。そこで,ザイオソフト社と解析の自動化に取り組んで開発したのが,QZIP-ILDである。
1.QZIP-ILD
QZIP-ILDは,人工知能(AI)を用いて間質性肺炎の胸部CTの領域分割を行うソフトウエアである。約100症例の間質性肺炎のCT画像から1000個以上のサンプルを抽出し,ニューラルネットワークで解析した。100症例のラベリングは,正常,肺気腫,すりガラス影,網状影,牽引性気管支拡張,線維化,コンソリデーション,蜂巣肺について3方向(軸位断,冠状断,矢状断)で行った。特発性肺線維症(idiopathic pulmonary fibrosis:IPF)の症例でのQZIP-ILDの解析結果を図2に示す。典型的な症例では,IPFのCT画像は通常型間質性肺炎(usual interstitial pneumonia:UIP)パターンを示すが,UIPの初期像は胸膜直下のとげ状のごく小さい病変であることが知られ見逃しやすい(図2 a,b)。QZIP-ILDでは,特にこの胸膜直下の病変を抽出できるようにラベリングした。また,喫煙者では肺気腫と間質性肺炎が併存することもよくあるが,肺気腫の壁が線維化で厚く見えることもしばしば経験する。こうした囊胞壁の線維化もできるだけ抽出できるようにラベリングした(図2c,d)。
2016年度に当センターを初診した特発性の線維化性間質性肺炎の116症例の解析では,QZIP-ILDで測定したCTでの肺病変の広がりは,単変量解析で生命予後との関連が見られた。また,肺活量(% FVC),年齢,性別で層別化した多変量解析(Coxの生存分析)でもQZIP-ILDで計測した病変の広がりは独立した予後因子であった。
QZIP-ILDでは,肺葉ごとの結果の表示や肺の表面のみの病変の表示も可能である。残念ながら,QZIP-ILDも手動での修正を必要とする症例はあるが,GHNCに比較すれば頻度は少なく,かなり改良されている。
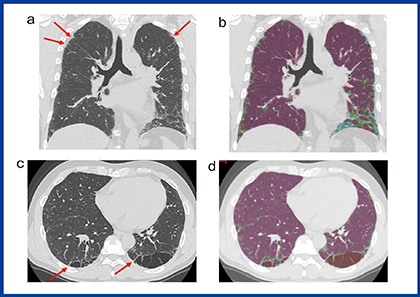
図2 特発性肺線維症のCT画像とQZIP-ILDの解析結果
症例上(a, b) 60歳代,男性,上葉の胸膜直下の線維化と思われる小さなとげ状の構造(a→)もQZIP-ILDで検出できている。
症例下(c, d) 60歳代,男性,囊胞状の気腫状肺の辺縁部分の線維化と思われる索状構造(c→)もQZIP-ILDで検出できている。
* QZIP-ILDの色の説明:ピンク=正常,茶色=気腫状肺,黄緑=すりガラス影,水色=網状影,緑=牽引性気管支拡張,黄色=無気肺硬化型の線維化,オレンジ=コンソリデーション,紫=蜂巣肺
2.QZIP-ILDによる新型コロナウイルス(COVID-19)肺炎の解析
われわれは,以前にCOVID-19肺炎では病変部分の肺の容積減少が見られることを報告した8)。1024×1024の高精細のCT画像ではReidの小葉を認識できるが,正常ならおおよそ直径1cm前後のReidの小葉が,COVID-19肺炎の病変部位では小さく,局所の含気の低下が示唆された。さらに,われわれはQZIP-ILDでCOVID-19肺炎の肺病変を定量評価し,正常肺の減少とともに肺の全体の容積減少が見られること,同時にCOVID-19肺炎では病変部分の血管拡張が見られることを報告した9)。特に酸素投与を必要とするような中等症Ⅱ以上の症例では,これらの所見が目立っていた。生理学的には,換気が低下すれば肺血流も低下するはずである。COVID-19肺炎における,含気が低下した領域での血管拡張は,換気血流不均等を示唆する所見と考えている。このように,QZIP-ILDを利用した定量評価は,COVID-19肺炎の病態把握にも有用である。
3.QZIP-ILDによるCT肺病変の経時的変化の評価
現在,間質性肺炎の治療法は,ステロイド・免疫抑制剤による抗炎症治療と,抗線維化薬による治療の2種類あり,両者を同時に用いることもある。病理組織学的に細胞浸潤が目立つ間質性肺炎では,抗炎症治療が有効な場合が多いが,逆に線維化が主体の症例では,抗線維化薬を主に用いる。抗線維化薬の保険適用は,進行性線維化を伴う間質性肺疾患となっており,呼吸機能検査の明らかな悪化があれば適用となる。ただし,この基準を満たさない場合には,臨床症状の悪化やCTの経過で線維化の進行を示す必要がある。この場合,QZIP-ILDによる定量評価は有用と考える。
また,細胞浸潤については,当センターでは,積極的に外科的肺生検やクライオバイオプシーなどで,病理組織を採って細胞浸潤や線維化の程度を検討し,治療法を選択している。しかし,重症例では病理組織を採取することが困難で,その場合はステロイド・免疫抑制剤を短期に使用し,効果があればその治療を続行することが,臨床的にしばしば行われる。こうした症例では呼吸機能検査もできないことが多く,治療効果判定にはCTが用いられる。一定の基準でCTを評価できるQZIP-ILDは,治療効果判定の客観的指標としても有用と考える。
ところで,線維化も細胞浸潤も局所のCT値を上昇させるので,CT値だけでは両者を区別することはできない10)。CTで線維化を示す所見として重要なのは牽引性気管支拡張であり,牽引性気管支拡張を伴う病変は線維化を強く疑う。ただし,線維化と細胞浸潤が同時に存在する場合には,CTで牽引性気管支拡張を伴う病変であっても,ある程度ステロイド・免疫抑制剤で改善する場合がありうる。今回のQZIP-ILDでは,ラベリングの段階で,無気肺硬化型の線維化が主体のコンソリデーションは黄色,抗炎症治療である程度改善した症例のコンソリデーションをオレンジに分けて色づけした。図3に示す症例は60歳代,男性で,徐々に進行する胸部異常影で紹介となった。CTでは上葉には牽引性気管支拡張を伴うUIPパターンが認められ,高度な線維化が示唆された。下葉には気管支血管束沿いのコンソリデーションおよびすりガラス影が認められ,多彩な所見を示している。抗核抗体などもすべて陰性で,外科的肺生検でも特定の間質性肺炎と診断できず,最終的に分類不能型間質性肺炎とされた。病理組織像で下葉では細胞浸潤が目立ったことから,ステロイド・免疫抑制剤を投与したところ,下葉の病変は改善傾向にあり,呼吸機能検査も改善した。QZIP-ILDでは上葉の黄色の領域は残っているが,下葉のオレンジの領域は減少していることがわかる。QZIP-ILDで,線維化のみの病変と,線維化と細胞浸潤が混在する病変をどこまで区別できるかは,今後,さらに検討が必要と考えている。
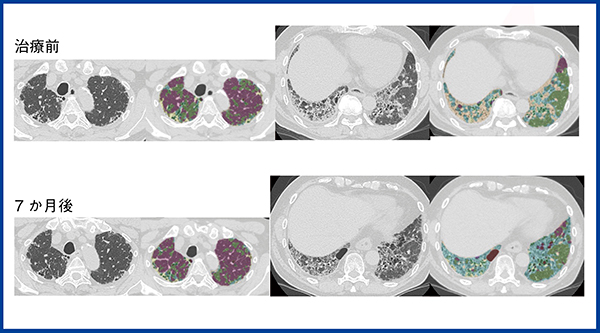
図3 60歳代,男性,分類不能型の間質性肺炎
治療前および治療後のCTとQZIP-ILDの解析結果。治療前,呼吸機能検査では%FVC:44.2%,%DLCO:73.5%であったが,ステロイドパルス,エンドキサンパルス,その後のステロイド投与により,7か月後,%FVC:53.2%,%DLCO:86.7%まで回復した。CT画像では下葉のコンソリデーション(オレンジ)の領域は消退している。
間質性肺炎の進行に伴う肺のゆがみ(移動量)
肺は,正常では体積の80%が空気である。したがって,線維化とともに虚脱が起こると,正常肺の減少に比較して,病変の容積増加は少ない7)。特にUIPパターンの線維化では,初期には胸膜に張りつくように線維化が起こるため,虚脱した肺が胸膜と一体となってCTでは認識しづらい。QZIP-ILDのような定量解析を行っても,虚脱を伴う線維化では体積が1/5に減少するため,病変の増加はごくわずかで,疾患進行を見逃しやすい。しかし,線維化自体は見えなくても,局所の肺の構造のゆがみは起こっている11)。CTを注意深く観察すると,UIPでは末梢の血管が徐々に胸膜に近づいていくのがわかる(図4上段)。
われわれは,この肺の末梢構造のゆがみを移動量として計測することにより,肺内で起こっている線維化を検知できないかと考えた。この移動量を可視化するため,非剛体位置合わせを利用した手法をザイオソフト社と開発した。非剛体位置合わせは,呼吸による位置ズレがある胸部では,例えば単純CTと造影CTを重ねる際などに現在広く行われている手法である。通常は位置ズレを補正して2枚の画像を重ねるが,今回は各ポイントの位置のズレを移動量として元画像に重ねて,カラーマップで表示した(図4下段)。カラーマップにより,わずかな血管の位置移動が把握しやすくなると考えている。この手法を用いて,IPF 41症例について,肺の内側,外側1cmの領域に分けて病変の容積と移動量を測定したところ,線維化病変は肺の外側に多く,移動量も外側に多いことがわかった12)。本手法の有用性について,今後,さらなる検討を重ねたい。
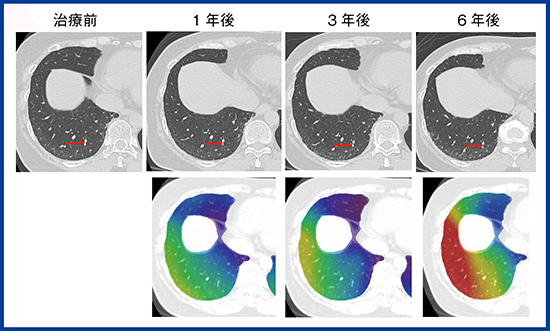
図4 50歳代,女性,特発性肺線維症(IPF)
CT画像と移動量のカラーマップ表示。QZIP-ILDによる病変の体積は初診時2.5%, 1年後3.0%,3年後3.9%,6年後4.4%とわずかに増加していたが,肺全体の容積減少はわずかだった。CTの元画像では胸膜下の血管がだんだんと胸膜に近づいている(→)。移動量では下葉背側末梢を中心に大きな移動を示す赤色が広がっている。
まとめ
QZIP-ILD などを用いた定量評価は,びまん性肺疾患の病態解明に役立つと考えられる。
●参考文献
1)Hebisawa, A., et al. : Lung Disease Associated with Rheumatoid Arthritis. Springer, Singapore, 33-42, 2018.
2)Nakano, Y., et al., Am. J. Respir. Crit. Care Med., 162(3 Pt1):1102-1108, 2000.
3)Tanabe, N., et al., Thorax., 76(3):295-297, 2021.
4)小口 翼,他, 第80回日本医学放射線学会総会, CyPos(ROP38-4), 2021.
5)Uppaluri, R., et al., Am. J. Respir. Crit. Care Med., 160(2):648-654, 1999.
6)Maldonado, F., et al., Eur. J. Respir. 43(1):204-212, 2014.
7)Iwasawa, T., et al., Eur. J. Radiol., 83(1):32-38, 2014.
8)Iwasawa, T., et al., Jpn. J. Radiol., 38:394-398, 2020.
9)Aoki, R., et al., Jpn. J. Radiol., 38(5):451-458, 2021.
10)Iwasawa, T., et al., Eur. J. Radiol., 90:106-113, 2017.
11)岩澤多恵,他,画像診断,40(11):A140-153, 2020.
12)Yasuda, N., et al., RSNA, 2021.
岩澤 多恵(Iwasawa Tae)
1986年 横浜市立大学医学部卒業。92年 同大学大学院医学研究科修了。同大学放射線科助手,講師を経て,97年 神奈川県立循環器呼吸器病センター。2006年~同センター放射線科部長。2018年~同医療局長,2021年〜副院長。放射線診断専門医,核医学専門医,横浜市立大学放射線科客員教授。
- 【関連コンテンツ】
