臨床におけるDeep Learning Spectral Imagingの初期経験
中村 優子(広島大学大学院医系科学研究科放射線診断学研究室)
Session2
2019-11-25

当院では2019年6月より,キヤノンメディカルシステムズの新しいDual Energy CT(DECT)技術である“Spectral Imaging System”がAquilion ONE/GENESIS Editionに搭載され稼働している。本講演では,臨床の視点からDECTに求められるものと現状について述べ,腹部領域におけるSpectral Imaging Systemの有用性について,初期臨床経験を基に報告する。
■DECTに求められるものと現状
1.DECTの臨床的有用性
2つのエネルギーで撮影するDECTには,(1) 仮想単色X線画像を作成できる,(2) 定量できるパラメータ(物質弁別,実効原子番号,電子密度)がある,という特長がある。Spectral Imaging Systemでも,さまざまなエネルギーレベルの仮想単色X線画像やヨードマップ,仮想非造影CT画像を作成することができる。
原発性肝細胞がんにおけるDECTの有用性については,すでに複数の報告がある。仮想単色X線画像1)〜3)は,エネルギーレベルの低い画像で造影効果が増強することから,多血性原発性肝細胞がんの検出能向上,あるいは造影剤量の減量が可能となる。また,ビームハードニングアーチファクトの低減により,金属アーチファクトの低減や,高体重患者における病変検出能が向上する可能性があると報告されている。
物質弁別の有用性としては,仮想非造影CTとヨードマップが得られることが挙げられる4)〜6)。仮想非造影CTで単純CTを代替できれば被ばく線量を低減でき,ヨードマップについては,腫瘍背景肝コントラストの向上や脈管侵襲の有無の確認,原発性肝細胞がんとその他の多血性肝腫瘍との鑑別に有用との報告がある。
2.DECTの問題点
仮想単色X線画像は,70keVよりも低いエネルギー領域で造影効果が増強するが,ノイズレベルも増加するため画質の劣化が問題となる。これに対しては,画像表示条件(WW/WL)を変更する方法や,ノイズの上昇を抑制する新たな解析アルゴリズムが報告7),8)されているが,普遍的な画像を安定して得られてはいないのが現状である。
物質弁別については,仮想非造影CTはヨードの除去が不十分,石灰化や金属の濃度が減弱する,CT値が不安定などさまざまな問題が指摘されており,単純CTを代替するまでに至っていない6),9),10)。また,ヨードマップは,撮影機種や物質弁別の手法によってヨードの定量値が変化することが問題であり,現状では普遍的な画像検査とは言えない。
3.DECTに求められるもの
現在の画像診断は,これまで蓄積されてきた膨大なSingle Energy CT(SECT)のデータの上に成り立っている。特に,原発性肝細胞がんは,SECTで典型的な画像を呈すれば確定診断が可能なほど,検査として確立されている。よって,DECTがSECTを代替するには,SECTで得られる情報が担保されねばならない。加えて,2つのエネルギー撮影で得られる追加情報の安定性も求められ,DECTには超えるべき壁はまだ多いと考える。
■臨床におけるSpectral Imaging Systemの有用性
DECTでは線量を増やさずに2つのエネルギーで撮影する必要があるため,ある程度の画質劣化はあると考えていたが,Spectral Imaging Systemでは良好な画像が得られている。
1.仮想単色X線画像
症例1の肝臓ダイナミックCTでは,超高精細CT「Aquilion Precision」で撮影したSECT(図1 a)と比べてDECT(図1 b)の画質に遜色はなく,CTDIはSECTが16.3mGy,DECTが16.9mGyとほとんど差はなかった。SECTに従来CTを用いた症例でも,同様の結果が得られた。
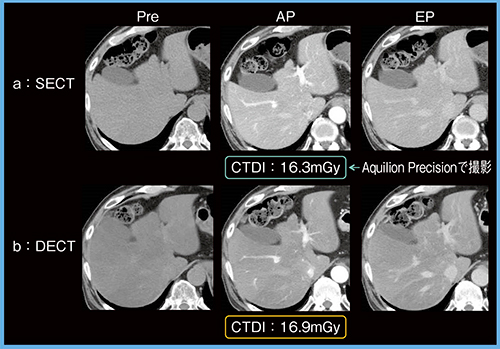
図1 症例1:SECT(Aquilion Precision)とDECTの画像比較
症例2(原発性肝細胞がん,70歳代,男性)の各エネルギーレベルの仮想単色X線画像を見ると,70keVの画像は非常に明瞭である(図2)。40,50keVでは造影効果は増強するものの,ノイズが多く診断には適さないため,低エネルギー領域の画質改善が望まれる。
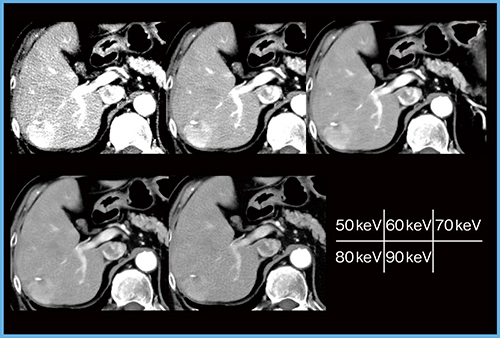
図2 症例2:原発性肝細胞がん(70歳代,男性)の各エネルギーレベルの仮想単色X線画像
症例3は,微小な原発性肝細胞がん(70歳代,女性)であるが,70keVの平衡相画像ではwashout(←)を確認しやすい(図3)。
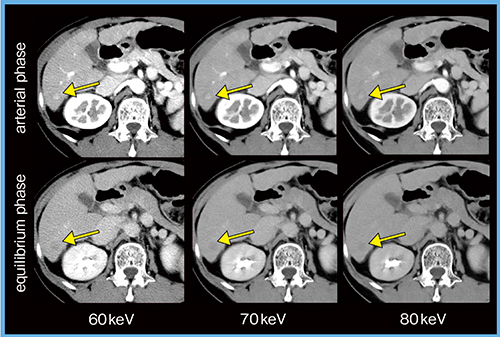
図3 症例3:原発性肝細胞がん(70歳代,女性)の仮想単色X線画像
症例4(直腸がん術後,60歳代,女性)は,腫瘍マーカーの上昇があり,造影1相で撮影を行った(図4)。70keV画像で低吸収域(→)が認められたが,非常に淡い陰影のため,ノイズがあると見落としていた可能性もある。後日撮像されたFDG-PETで強い集積(→)が認められ,肝転移であると診断された。
このようにSpectral Imaging Systemによる仮想単色X線画像は,被ばく線量を増加することなくSECTと遜色ない画像を得られ,かつノイズが抑えられているため,非常に小さな病変の検出に有用であると考えられる。
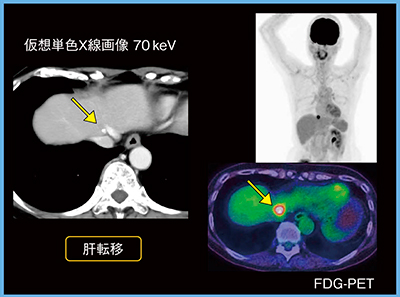
図4 症例4:直腸がん術後(60歳代,女性)の肝転移の検出
2.物質弁別
Spectral Imaging Systemでは仮想非造影CTやヨードマップの作成が可能である。ただし仮想非造影CTは,腫瘍と肝臓のコントラスト低下や,血管内に造影剤が残るといった課題があり,現時点では単純CTを代替することは難しい。他社の仮想非造影CTについても同様の報告がされている10),11)。
一方,ヨードマップは,臨床に有用な情報を提供する。症例5(肝腫瘍疑い,60歳代,男性)は,仮想単色X線画像(図5 a)で門脈内に造影不良域が認められた。原発性肝細胞がんにおいては,門脈内の造影不良域の鑑別が治療方針に大きく影響する。ヨードマップ(図5 b)では,造影不良域にヨードの取り込みがないことが確認され(→),門脈血栓と診断できる。同様の検討は複数報告されている12),13)。
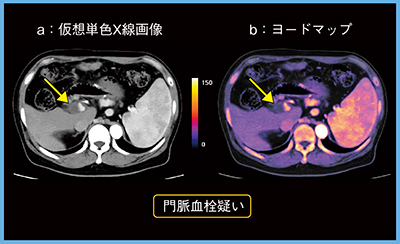
図5 症例5:肝腫瘍疑い(60歳代,男性)の仮想単色X線画像(a)とヨードマップ(b)
また,原発性肝細胞がんにおけるDECTは,治療効果判定に有用とする報告が多い14)。症例6(原発性肝細胞がんのRFA後,70歳代,男性)では,ヨードマップでは造影不良域が明瞭に描出され,焼灼範囲を容易に確認することができる(図6)。
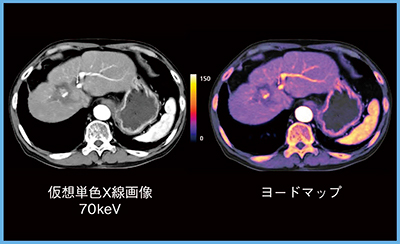
図6 症例6:原発性肝細胞がんRFA後(70歳代,男性)
症例7(胆管がん術後,骨転移治療後,40歳代,男性)は,胸椎レベルの骨転移への放射線治療後も腫瘍マーカーが上昇し続けていた。骨転移の再燃も疑われたが,動脈相・平衡相の仮想単色X線画像に大きな変化はなくヨードマップでもヨードの取り込みは乏しく,再燃とは言い難い所見であった(図7 a)。しかし,平衡相の骨盤レベルで左骨盤骨に沿って腫瘤影が出現しており,ヨードマップで明らかな取り込みが確認でき,新たな骨転移が腫瘍マーカー上昇の原因であった(図7 b↑)。
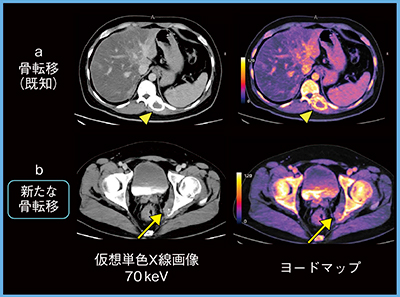
図7 症例7:胆管がん術後,骨転移治療後(40歳代,男性)の平衡相
このように,Spectral Imaging Systemの物質弁別では付加情報を得られるが,仮想非造影CTや定量性については,今後の検討が必要である。
■まとめ
DECTには,SECTで得られる情報の担保と2つのエネルギーで撮影することによる追加情報の安定性が求められる。
Spectral Imaging Systemでは,被ばく線量を増加させることなく安定した画質の仮想単色X線画像を作成でき,かつノイズも低減している可能性が高い。また,物質弁別による情報は有用な可能性が高いが,仮想非造影CTや定量性については今後の検討が必要である。今後はさらに,実効原子番号や電子密度の有用性についても検討を行っていきたい。
●参考文献
1)Lv, P. et al., Radiology, 259, 720〜729, 2011.
2)Bayasgalan, E., et al., Hiroshima Journal of Medical Sciences, 67, 63〜69, 2018.
3)Nagayama, Y., et al., Eur. Radiol., 28, 1719〜1730, 2018.
4)Pfeiffer, D., et al., Abdom. Radiol.(NY), 43, 3317〜3323, 2018.
5)Yang, CB., et al., Eur. J. Radiol., 95, 222〜227, 2017.
6)Kaltenbach, B., et al., Eur. J. Radiol., 105, 20〜24, 2018.
7)De Cecco, C.N., et al., Eur. J. Radiol., 85, 695〜699, 2016.
8)Grant, K.L., et al., Invest. Radiol., 49, 586〜592, 2014.
9)De Cecco, C.N., et al., Eur. Radiol., 20, 2870〜2875, 2010.
10)Obmann, M.M., et al., Invest. Radiol., 54, 1〜6, 2019.
11)Ananthakrishnan, L., et al., Abdom. Radiol.(NY), 42, 702〜709, 2017.
12)Qian, L.J., et al., Eur. Radiol., 22, 2178〜2185, 2012.
13)Ascenti, G., et al., Clin. Radiol., 71, 938.e1〜e9, 2016.
14)Lee, S.H., et al., Invest. Radiol., 46, 77〜84, 2011.
