技術解説(シーメンスヘルスケア)
2019年4月号
Cardiac Imagingにおけるモダリティ別技術の到達点
Ready beyond tomorrow with Dual Source CT─高い時間分解能がもたらす臨床的意義
日和佐 剛(CT事業部)
冠動脈疾患に加えて構造的心疾患にもカテーテル治療の恩恵が広がり,心臓CTが担うべき役割も増している。冠動脈疾患では,高心拍や不整脈症例といった難易度が高い心拍条件への対応をはじめ,腎機能低下患者に対する造影剤低減,さらには経皮的冠動脈形成術(以下,PCI)の適正使用に向けた心筋の機能的虚血の評価を行う必要性が高まっている。また,構造的心疾患の術前プランニングやフォローアップにおいては,すべての心位相を観察することで詳細な解剖構造を把握することが重要となっている。本稿では,Dual Source CTの高い時間分解能がもたらす臨床的意義について,虚血評価の選択肢の一つとしても期待が高まるダイナミック負荷心筋パーフュージョンCT検査と,構造的心疾患への適応について概説する。
●高い時間分解能がもたらす臨床的意義と負荷心筋パーフュージョンCT検査への応用
最高66msのハードウエア時間分解能(ハーフ再構成)を有するDual Source CTに,最大2600mAの管電流出力が備わったことで,低管電圧撮影による造影剤低減を含めた低侵襲な心臓撮影が可能となった(図1)。近年は,高齢化を背景とする心不全パンデミックの到来が議論される機会も増えているが,心不全患者で課題となる腎機能低下や不整脈などの多種多様な併存疾患1)を有する症例においても,安定して冠動脈CT検査を実施することができる(図2)。
また,国内でも保険収載されたハートフロー社の“FFRCT”に対する解析精度については,マルチベンダー/マルチスキャナの冠動脈CT画像を用いた精度検証ではacceptance rateが86%であったのに対して,Dual Source CTにスキャナを絞った場合は冠動脈疾患の検査前確率が低・中等度リスクの患者群で99%,高リスクの患者群では97%であったことが示されており,Dual Source CTによる精度の高い冠動脈画像の取得が可能であることが報告されている2),3)。
一方,ダイナミック負荷心筋パーフュージョンCT検査では,撮影中の血管拡張薬投与によって心拍上昇が避けられないが,Dual Source CTでは撮影心位相を収縮末期とすることができるため,心拍変動や不整脈による形態変化の影響も受けにくい。そして,収縮末期のデータを用いて虚血評価を行うことができるため,心筋の内膜側と外膜側の血流差を評価しやすい特長も持っている(図3)。
加えて,Dual Source CTによるダイナミック負荷心筋パーフュージョンCT検査は,2つのテーブル位置を交互に心電図同期撮影することで,被ばくとサンプリングレートを最適化している。CT値の変化が緩やかな心筋に対しては上下交互にサンプリングするのに対して,急激なCT値変化が起こる大動脈についてはダブルサンプリングを行っており,線量を抑えたダイナミックデータの取得を実現している。
また,画像再構成には正確で再現性の高い定量解析を実現するための画像再構成アルゴリズム(targeted spatial frequency filtration:TSFF)を採用している4)。TSFFは,ハーフ再構成と360°データを利用したフル再構成の特長を組み合わせた画像再構成アルゴリズムであり,ハーフ再構成の高い時間分解能を維持したまま,かつ,心筋の正確なCT値計測の妨げとなるハーフ再構成のデータ収集アングルの違いに起因するアーチファクト抑制をねらった設計となっている。正確な心筋のCT値を計測することは,正確で再現性の高い定量解析につながる重要な要素であると考えている。

図1 高い時間分解能を生かした心臓CT
Dual Source CTでは66ms,または75msによる圧倒的な時間分解能の高さによって,動きによるアーチファクトの影響を抑制した動態評価が可能となっている。
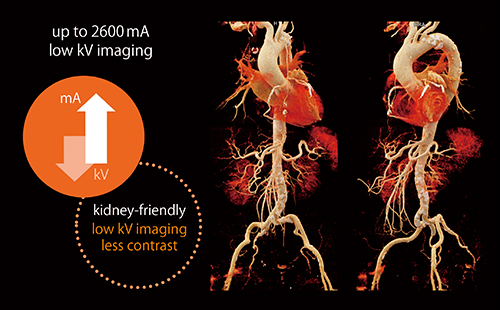
図2 低管電圧撮影による腎機能低下患者に対する造影剤低減
最大2600mAの管電流出力を可能とする低管電圧撮影によって,造影剤を低減した低侵襲な術前プランニングを実現している。
(画像ご提供:ドイツ・Cardioangiologisches Centrum Bethanien Frankfurt)
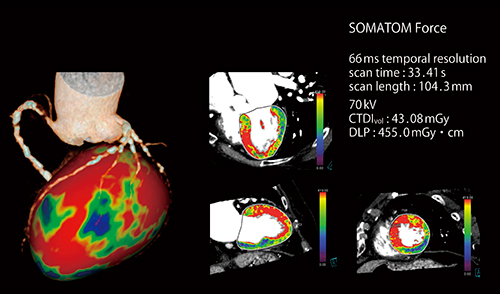
図3 ダイナミック負荷心筋パーフュージョンCT検査
Dual Source CTでは撮影心位相を収縮末期とすることができるため,心拍変動や不整脈による形態変化の影響を受けにくく,心筋の内膜側と外膜側の血流差を評価しやすい。
(画像ご提供:中国・Peking University Medical College)
●構造的心疾患における動態評価への応用
構造的心疾患に対するカテーテル治療の適応が拡大するに伴い,心臓CTは弁膜症の領域においても重要な役割を果たしている。正確な形態診断を行うには心周期すべての位相に対して動きによるアーチファクトの影響を排除する必要があるが,Dual Source CTでは圧倒的な時間分解能の高さによって,冠動脈だけでなく,心臓全体の解剖構造をアーチファクトの影響を抑えて描出可能である。
近年は,経カテーテル大動脈弁留置術において若年患者への治療適応が議論されるようになっており,新たに取り組むべき課題として,三尖弁と二尖弁の鑑別や,術後の弁血栓症の評価が必要とされている5)。特に,rapheと呼ばれる縫合線を認める二尖弁を三尖弁と区別するには,収縮期の画像評価をする必要があり,拡張期だけでなく収縮期も含めた包括的な動態評価が重要となっている。Dual Source CTでは,分割式再構成やmotion estimationなどの技術に依存することなく,ハーフ再構成によって常に66ms,または,75msの画像取得ができるため,拡張期から収縮期までのあらゆる心位相において高い時間分解能を生かした動態評価が可能である6)。
また,僧帽弁閉鎖不全症(以下,MR)に対するカテーテル治療は,COAPT試験によって心不全を有する機能性MRについても有効性が示され,今後の適応拡大が期待されている。心不全患者では前述のとおり,腎機能低下や不整脈をはじめとする併存疾患への対応が不可欠であるが,Dual Source CTでは高い時間分解能に加え,最大2600mAの管電流出力を背景とする低管電圧撮影を組み合わせることで,すでに造影剤低減を含めた低侵襲な撮影を実現している。
◎
2対のX線管-検出器システムを搭載するDual Source CTは,Single Source CTの約半分の時間分解能を有しており,難易度が高い心拍条件における正確な冠動脈疾患の除外診断や,精度の高い心筋虚血の定量評価,さらにはすべての心周期における弁の詳細な動態評価など,適切な治療選択や予後予測に大きく貢献している。常に拍動する心臓の解剖構造を正確にとらえ,今後必要とされるクリニカルベネフィットにも応えるには,CT装置の時間分解能向上が重要と考えている。
●参考文献
1)Levine, A., et al. : Cardiac CT Angiography in Congestive Heart Failure. J. Nucl. Med., 56 (Suppl. 4), 46S〜51S, 2015.
2)Norgaard, B.L., et al. : Diagnostic performance of noninvasive fractional flow reserve derived from coronary computed tomography angiography in suspected coronary artery disease ; The NXT trial(Analysis of Coronary Blood Flow Using CT Angiography ;
Next Steps). J. Am. Coll. Cardiol., 63・12, 1145〜1155, 2014.
3)Jensen, J.M., et al. : Computed tomography derived fractional flow reserve testing in stable patients with typical angina pectoris ; Influence on downstream rate of invasive coronary angiography. Eur. Heart J. Cardiovasc. Imaging, 19・4, 405〜414, 2018.
4)Ramirez-Giraldo, J.C., et al. : A strategy to decrease partial scan reconstruction artifacts in myocardial perfusion CT ; Phantom and in vivo evaluation. Med. Phys., 39・1, 214〜223, 2012.
5)De Backer, O., et al. : Challenges When Expanding Transcatheter Aortic Valve Implantation to Younger Patients. Front. Cardiovasc. Med., 5, 45, 2018.
6)Alkadhi, H., et al. : Cardiac CT for the differentiation of bicuspid and tricuspid aortic valves ; Comparison with echocardiography and surgery. Am. J. Roentgenol., 195・4,
900〜908, 2010.
●問い合わせ先
シーメンスヘルスケア株式会社
コミュニケーション部
TEL 0120-041-387
https://www.siemens-healthineers.com/jp/
