技術解説(シーメンスヘルスケア)
2020年3月号
Dual Energy CT(DECT)の技術の到達点
Expanding Precision Medicine through Innovation ─ precision medicine時代に「SOMATOM CT」が 実現するTrue Dual Energy Imaging
藤原 知子(シーメンスヘルスケア(株)CT事業部)
近年,改めて注目されているdual energy CT(以下,DECT)であるが,その研究の歴史は長く,1980年代にはすでにKalenderらにより高速kVスイッチング方式を利用した「SOMATOM DR」による骨塩密度解析への応用が報告されている1),2)。DECTは,異なるX線エネルギーにおいて物質の線減弱係数が変化する現象を利用したイメージングであるが,その名のとおり,2種類の異なるX線エネルギーを用いて得られたデータを解析する。その方法はさまざまであり,Siemens Healthineersの開発の歴史においても,前述の「高速kVスイッチング方式」や「2層検出器方式」などの研究を経て,種々の課題を克服した上で,2005年「Dual Source方式」をリリースするに至った(図1)。以降,多くのエビデンスを重ねながら,今日では,Single Source方式での“TwinBeam Dual Energy”や“Dual Spiral Dual Energy”といった方式も採用している。
Siemens Healthineersが提供する,これらすべての方式に共通する開発テーマは“True Dual Energy”であり,single energy CT(以下,SECT)と比べて画質や被ばくに妥協がないこと,2種類のエネルギーの差(energy separation)を確保することで解析精度を上げること,日常検査のワークフローにスムーズに導入できることなどをコンセプトに掲げている。
現在では,主だったCTベンダーよりDECTが可能なシステムが出そろい,主に仮想単色X線画像(monoenergetic image, monochromatic image)がトピックとなっている。造影コントラストの向上や金属アーチファクトの低減など,ますますDECTの裾野が広がることを期待している。
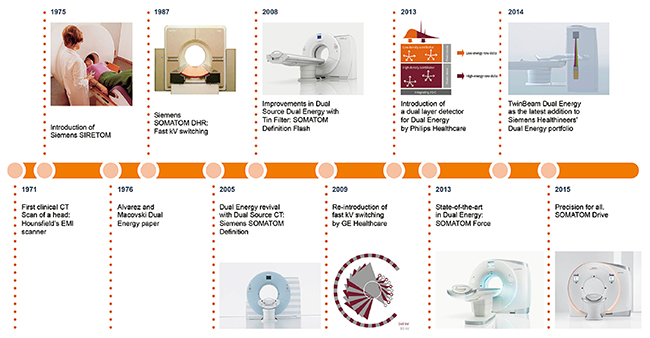
図1 Siemens HealthineersにおけるDECTの歴史
True Dual Energy
「SOMATOM CT」のdual energyが臨床にスムーズに導入された背景には,やはりTrue Dual Energyのコンセプトが強く影響していると考えられる。新しいイメージング法を導入する際,現在のルーチンワークフローを大きく妨げる類のものは一般に受け入れ難い。その点,SOMATOM CTでは,DECTを行ってもSECTに比べて被ばくが増えず,また,読影用画像を別に撮影する手間がない点は,大きなアドバンテージと言える。
1.Dose neutral dual energy imaging
DECTによる付加情報を制約なく活用するためには,画質を犠牲にすることなく,SECTと同等,もしくはそれ以下の線量で付加情報を提供することが重要と言える。
SOMATOM CTのDECTでは,被検者の体格や撮影部位に合わせて最適な管電流調整を行う“CARE Dose4D”や“X-CARE”をはじめ,モデルベース逐次近似画像再構成法である“SAFIRE(Sinogram Affirmed Iterative Reconstruction)”や“ADMIRE(Advanced Modeled Iterative Reconstruction)”を併用した,被検者個々に合わせた撮影線量の最適化ができる(図2)。また,金属の種類や撮影部位に応じて最適化された8つのアルゴリズムを持つ金属アーチファクト低減技術の“iMAR(iterative Metal Artifact Reduction)”を使用することで,金属アーチファクトの影響を最小限に抑えたDECTを行うことが可能である。
ハードウエアの面では,スパイラル撮影の開始と終了,それぞれの撮影領域における無効被ばくをカットする可動式コリメータの「Adaptive Dose Shield」を搭載している。また,自社開発のX線高感度素子である「UFC(Ultra Fast Ceramic)」シンチレータの搭載に加え,低管電圧画像で問題となる電気ノイズを低減すべく,検出器のアナログ回路を排除したフルデジタル検出器の「Stellarinfinity Detector」を採用している3)。低管電圧画像の画質が向上することは,DECTの解析精度を向上させ,さらには撮影線量の最適化においても有効に働く。
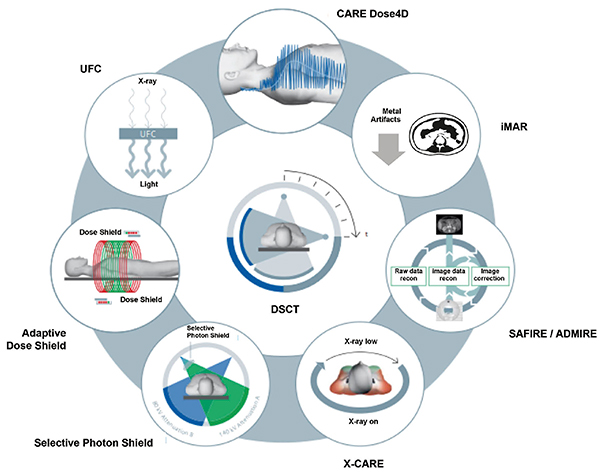
図2 DECTにおいても各種被ばく低減機構を併用可能
2.Dual energy imaging quality criteria, best spectral separation
DECTにおけるスキャナの性能として,次の指標が重要とされている。
・X線スペクトルの分離(energy separation)
・収集データの時差(temporal coherence)
・時間分解能(temporal resolution)
・空間分解能(spatial resolution)
・線量効率(dose efficiency)
特に,X線スペクトルの分離(energy separation)は重要で,物質のX線エネルギー依存性を利用するDECTでは,高低2つのX線スペクトルが大きく分離しているほど線減弱係数の差が大きくなり,結果として物質弁別の精度が高くなる4),5)。現在,DECTにおいて,より客観的な指標を提供するという観点から定量値としての期待が高くなっており,定量値としての運用を考えた場合は,特に精度の高い撮影が望まれる。SOMATOM CTにおけるDECTでは,2つのエネルギーに関するデータ収集系が独立しているため,高管電圧側において,2つのX線スペクトルの重なりを減少させる「Selective Photon Shield」(以下,SPS)を実装することができる。SPSは,スズ(Sn,Tin)の合金を主体とした物理フィルタで,X線スペクトルの低エネルギー成分を効率的にカットし,平均エネルギーを上昇させる効果がある。その結果,DECTにおける物質弁別の精度向上と,被ばく低減が可能となっている(図3)。
また,X線スペクトルの重なりを減少するもう一つのメリットとして,一般的に低管電圧側として使用される80kVによるDECTに加え,90kVや100kVなど,低管電圧側をより高い管電圧とした組み合わせが可能となることが挙げられる。低管電圧側のX線出力が向上することは,体格の大きな被検者に対する解析精度が向上するだけでなく,腹部,骨盤といった比較的減弱が高い領域や,最も高いX線出力が必要とされる心臓撮影においても安定した解析精度を担保することにつながる。
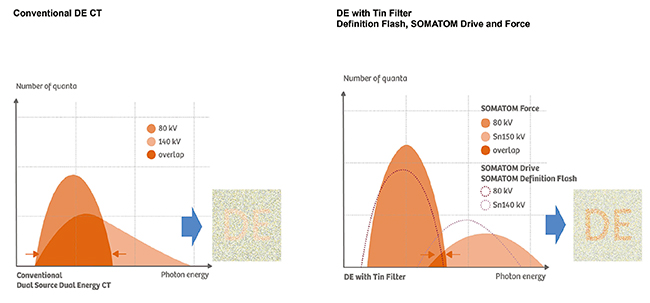
図3 SPSによるenergy separationの向上
3.“Rapid Results” ─zero click dual energy
2017年のRSNA(北米放射線学会)のPlenary Sessionでも話題に上がっていたように,DECTがさらに普及していくためには,CT検査,解析,読影業務のワークフローの中にうまく組み入れられることが重要なポイントである。そこで,生成される多量のデータセットを効率的に処理し,価値ある付加情報をよりスムーズに日常臨床に届ける手段として,Rapid Resultsが開発された(図4)。Rapid Resultsは,ユーザーのマニュアル操作を介さない新しい解析方法であり,事前にプリセットされたルールに基づいて「syngo.via」が自動的に解析を実施し,その結果画像をPACSに送信する仕組みとなっている。現在,国内の多くの施設で日常的に実施されている肺血栓塞栓症患者に対するDECTを例に説明すると,Rapid Resultsを利用すれば,高低2つのエネルギーデータセットをsyngo.viaに送信設定しておくだけで,残りのpost processingがすべて自動的に実施される。まず,“syngo.CT DE Lung Analysis”によって肺野のヨード分布画像が作成され,続いて,事前に定義したスライス厚とスライス間隔による結果画像がアキシャル画像やコロナル画像,サジタル画像として作成される。その後,指定されたPACS にこれら結果画像が自動送信される。Rapid Results を用いることで,日常検査のワークフローを変更することなく,DECTによる付加価値を活用することが可能となっている。
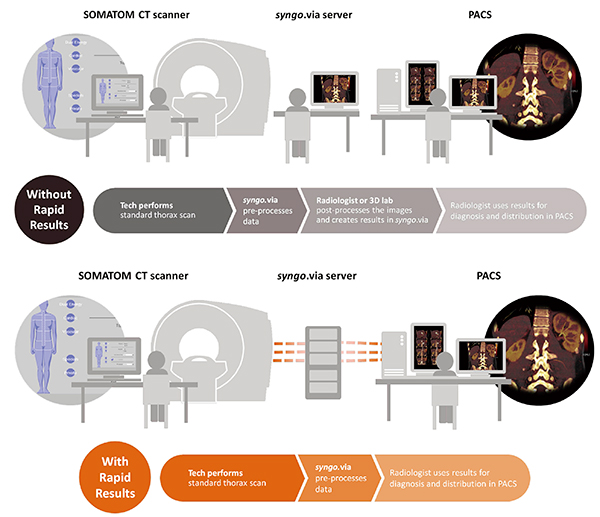
図4 Rapid Resultsの概要
Basic principles
DECTは,物質の線減弱係数がX線の平均エネルギーに依存して固有の変化を起こすことを利用した解析手法である6),7)。つまり,骨や造影剤などの異なる物質は,撮影に利用した2種類のX線エネルギー差に応じて固有のCT値変化を起こし,縦軸を低管電圧画像のCT値,横軸を高管電圧画像のCT値としたグラフにプロットすると,それぞれの物質は一定の傾きを持った分布を示す(図5)。
1.2-material decomposition
2つの物質を識別する分離線を定義することで物質を弁別する(図5 a)。例えば,“syngo.CT DE Direct Angio”では,骨とヨード造影剤の分離線を定義して,一度の撮影で骨を除去したMIP画像やvolume rendering technique(VRT)画像を作成することができる。
2.3-material decomposition
主に,造影画像におけるヨード成分の定量と仮想単純画像を作成する手法である(図5 b)。代表的なアプリケーションである“syngo.CT DE Liver VNC”では,肝臓を軟部組織と脂肪で構成される組織と定義しており,単純画像においては脂肪と軟部組織を結んだ線上にすべての肝臓のCT値がプロットされると仮定している。造影後は,肝臓に取り込まれたヨード量に応じてCT値の変化が生じ,グラフ上のプロットはヨードの傾きに沿ってシフトする。ヨードの傾きは管電圧の組み合わせによって既知であり,シフトした距離を計測することで,造影画像におけるヨード量を定量することができる。このヨード成分の画像(Iodine map)を造影画像から差分することで,仮想単純画像(VNC)を作成することが可能となる。頭部領域では“syngo.CT DE Brain Hemorrhage”,胸部領域ではsyngo.CT DE Lung Analysisがこの手法に該当する。
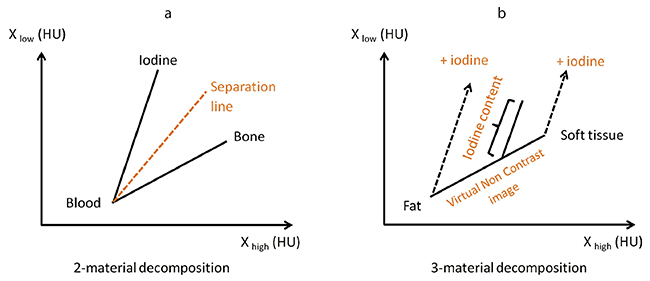
図5 Dual energy解析
a:2-material decomposition b:3-material decomposition
Broad clinical applications
2005年のDual Source CT「SOMATOM Definition」登場以降,臨床使用に耐えうる条件が満たされ,DECTに関する論文数もおおむね毎年増加している。
多くの論文が出されているのが胸部領域であり,国内で最も使用頻度の高いアプリケーションも,胸部領域の“syngo.CT DE Lung Analysis〔DE Lung PBV(Perfused Blood Volume)を含む〕”で,肺血栓塞栓症診断に広く用いられている。SECTと同様に肺動脈内血栓を評価できるのはもちろん,付加情報として肺胞間質レベルでの造影剤分布を同時に評価することができる。SECTで評価困難な場合がある末梢動脈の小血栓についても,灌流低下域として描出されるIodine mapを同時に詳細に確認することで診断能が向上する8)〜10)。肺血栓塞栓症のうちの数%が移行すると言われている慢性血栓塞栓性肺高血圧症(CTEPH)の治療方針決定のためには鑑別診断が非常に重要となり,また,重症度判定に対してもsyngo.CT DE Lung Analysisの可能性が示されている11)〜13)。
これまで比較的論文数の少なかった頭部領域においても,血管内治療の広まりに伴い,術後出血と漏出したヨード造影剤の鑑別に対して,DECTの需要が増えてきている14)。また,“Time is Brain”と言われるように,緊急性の高い急性期脳梗塞の診断にも徐々に適応が広がっている。これには,仮想単色X線画像(syngo.CT DE Monoenergetic+)を用いて白質と灰白質のコントラスト差を最適化するエネルギーレベルを検討したもの15)や,物質弁別画像(3-material decomposition)を応用して白質と灰白質のコントラスト差を生む脂質を抑制することで仮想的な灰白質マップを作成し,水分量の違いを強調したもの(X-map16), 17))がある。SECTと同等の画像再構成スピードで,Rapid Resultsなどの解析ワークフローの向上も相まって,今後さらに急性期の領域でもDECTの適応が進んでいくものと思われる。
◎
Siemens Healthineersが撮影プロトコールを考える際,根幹となるコンセプトは“precision medicine”の拡充である。被検者本人の状態や病期に対する検査目的は個々に異なり,それぞれに求められるプロトコールも画一的なものではないと考えることに起因する。“precision medicine”というと,「遺伝子治療」などのキーワードが連想されるが,「画像診断」における“precision medicine”とは,従来の“personalized medicine/個別化医療”や“personalized low dose”の延長上にあるテーマとしてとらえている。また,その根本には「必要な方に,必要なタイミングで,必要な検査を」という大命題が存在している。
画像診断における“precision medicine(撮影プロトコールの最適化とも言える)”の例としては,以下のようなものが考えられる。拍動する心臓を画像化するためには高い時間分解能を優先したプロトコールを使用する。ヨード造影剤の使用量を極力抑えなければならない状態であれば,造影効果を高める低管電圧撮影を利用する。また,従来のCT検査では得られなかった情報を得るために,dual energy撮影を行う。放射線感受性の高い小児の検査や検診を目的とした撮影など,より被ばく低減が必要な領域では,一般撮影と同等レベルの線量まで究極に線量を低減した“Tin filter technology”を利用する。このように,最適なプロトコールを用いることで検査のアウトカムを高めている。日常臨床に普及し始めたDECTに関して,常に第一選択にすることを重視するわけではなく,あくまで「被検者に最適な検査を第一選択とする」ことを念頭に置きたい。
“precision medicine”の基本である「必要に基づく最適な検査の実践」は,ともすればオペレーションの複雑化を招きかねない。検査を最適化・個別化する一方で,検者サイドには統一された再現性の高い検査が求められる。これに対し,SOMATOM CTの“FAST(fully assisting scanner technologies)”機能は,複雑化するスキャン・画像再構成にかかわる作業をアシストし,煩雑な作業を解消することで検査全体のワークフロー向上をサポートし,検者が被検者のケアなど最も重要な業務に充てる時間を確保するためのサポートを行っている。“precision medicine”の拡充を支えるワークフローを整えることで,ますますDECTの日常臨床での適応範囲を広げるべく,今後も検討を進めていきたい。
●参考文献
1) Kalender, W.A., et al. : Vertebral bone mineral analysis : An integrated approach with CT. Radiology, 164(2): 419-423, 1987.
2) McCollough, C.H., et al. : Dual- and Multi-Energy CT : Principles, Technical Approaches, and Clinical Applications. Radiology, 276(3): 637-653, 2015.
3) Duan, X., et al. : Electronic noise in CT detectors : Impact on image noise and artifacts. Am. J. Roentgenol., 201(4) : W626-632, 2013.
4) Primak, A.N., et al. : Improved dual-energy material discrimination for dual-source CT by means of additional spectral filtration. Med. Phys., 36(4): 1359-1369, 2009.
5) Krauss, B., et al. : The importance of spectral separation : An assessment of dual-energy spectral separation for quantitative ability and dose efficiency. Invest. Radiol., 50(2): 114-118, 2015.
6) Alvarez, R.E., et al. : Energy-selective reconstructions in X-ray computerized tomography. Phys. Med. Biol., 21(5): 733-744, 1976.
7) Brooks, R.A. : A quantitative theory of the Hounsfield unit and its application to dual energy scanning. J. Comput. Assist. Tomogr., 1(4): 487-493, 1977.
8) Sakamoto, A., et al. : Quantification of lung perfusion blood volume with dual-energy CT : Assessment of the severity of acute pulmonary thromboembolism. Am. J. Roentgenol., 203(2): 287-291, 2014.
9) Okada, M., et al. : Added value of lung perfused blood volume images using dual-energy CT for assessment of acute pulmonary embolism. Eur. J. Radiol., 84(1):172-177, 2015.
10) Bhalla, A.S., et al. : Imaging protocols for CT chest : A recommendation. Indian J. Radiol. Imaging, 29(3): 236-246, 2019.
11) Takagi, H., et al. : Dual-energy CT to estimate clinical severity of chronic thromboembolic pulmonary hypertension : Comparison with invasive right heart catheterization. Eur. J. Radiol., 85(9): 1574-1580, 2016.
12) Masy, M., et al. : Dual-energy CT(DECT) lung perfusion in pulmonary hypertension : Concordance rate with V/Q scintigraphy in diagnosing chronic thromboembolic pulmonary hypertension (CTEPH). Eur. Radiol., 28(12): 5100-5110, 2018.
13) Frost, A., et al. : Diagnosis of pulmonary hypertension. Eur. Respir. J., 53(1): 1801904, 2019.
14) Naruto, N., et al. : Dual energy computed tomography for the head. Jpn. J. Radiol., 36(2): 69-80, 2018.
15) Yoshida, M., et al. : Dual-Energy Computed Tomography for Evaluating Acute Brain Infarction of Middle Cerebral Artery Territories :
Optimization of Voltage Settings in Virtual Monoenergetic Imaging. J. Comput. Assist. Tomogr., 43(3): 460-466, 2019.
16) Noguchi, K., et al. : A Novel Imaging Technique(X-Map)to Identify Acute Ischemic Lesions Using Noncontrast Dual-Energy Computed Tomography. J. Stroke Cerebrovasc. Dis., 26(1): 34-41, 2017.
17) Taguchi K., et al. :"X-Map 2.0" for Edema Signal Enhancement for Acute Ischemic Stroke Using Non-Contrast-Enhanced Dual-Energy Computed Tomography. Invest. Radiol., 53(7): 432-439, 2018.
