VARIAN RT REPORT
2019年1月号
がん医療における放射線治療最前線 No.1
免疫放射線治療の理論的背景と現状・今後の可能性
佐藤浩央*1/小此木範之*2/田巻倫明*3/吉本由哉*1/竹原由佳*3/鈴木義行*3(*1 群馬大学大学院医学系研究科腫瘍放射線学講座 *2 量子科学技術研究開発機構 放射線医学総合研究所病院 *3 福島県立医科大学医学部放射線腫瘍学講座)
はじめに
21世紀に入り,日本では強度変調放射線治療(IMRT)や定位放射線治療(SRT)などの高精度放射線治療が広く普及し,さらに2016年からは,一部のがんに限定されるものの,粒子線治療も保険適用となった。このように,周囲の正常組織に対する線量を抑えつつ腫瘍局所への高線量投与が可能になったことで,高い局所制御率が期待できる。一方,局所制御率の改善に伴い,さらなる予後(生存率)の向上のためには遠隔転移の抑制が重要となる。これまでにも遠隔転移抑制をめざして放射線治療と化学療法のさまざまな併用が試みられてきたが,結果は限定的であった。そこで近年,注目を集めているのが,急速に適応拡大が進む免疫チェックポイント阻害剤などの免疫治療との併用,いわゆる「免疫放射線治療」である。
近年の腫瘍免疫学の発展により,放射線治療が人体内での免疫応答を活性化・増強するメカニズムが解明されつつある。本稿では,放射線による免疫応答に関するわれわれの基礎・トランスレーショナル研究の成果と免疫放射線治療の現状について概説する。
放射線治療による抗腫瘍免疫の活性化
幼弱なT細胞が細胞障害性Tリンパ球に成熟するためには,がん特異的抗原を貪食した樹状細胞からの,また,成熟Tリンパ球が特異的にがん細胞を認識するためには,がん細胞自体からのHLA class I分子を介した抗原提示がそれぞれ必要である。その一方で,一部のがん細胞は,HLAの発現を低下させることで免疫寛容状態を形成している。われわれは,直腸がん患者の検体を用いた解析にて,温熱化学放射線治療が腫瘍のHLA class Iの発現を増強させることを明らかにし,免疫寛容状態を解除する可能性を示した1)。さらに,脳腫瘍自然発生ラットを用いた研究結果から,放射線治療とミクログリア(脳内で抗原提示を行う)投与の併用による生存期間の延長を報告している2)。
また,放射線治療により,種々の炎症性サイトカインや,HMGB1に代表される細胞障害関連分子パターン(DAMPs)などを放出する免疫原性細胞死(immunogenic cell death)が誘導される。HMGB1はトル様受容体を介して樹状細胞を活性化し,Tリンパ球の活性化を誘導する。われわれは,このHMGB1が,細胞株への放射線照射後48〜72時間に放出されることを報告した3)。さらに,術前照射が行われた食道扁平上皮癌患者の組織においても,放射線照射後にHMGB1発現が増強し,かつ,その発現が生存率に関連していることを報告した4)。加えて,化学放射線治療を受けた食道扁平上皮癌患者から,治療前・中・直後・終了1か月後に末梢血単核球を回収し,6種類のがん精巣抗原に対する特異的細胞障害性Tリンパ球数の変化をIFNγ-ELISPOTアッセイで測定した結果,16人中6人(38%)で抗原特異的細胞障害性Tリンパ球が増加していたことを,世界に先駆けて報告した4)。また,放射線治療は,Tリンパ球数の変化だけでなく,Tリンパ球の腫瘍内への浸潤を促進することも報告されている5)。このように,放射線による抗腫瘍免疫の活性化が明らかになってきている(図1)。
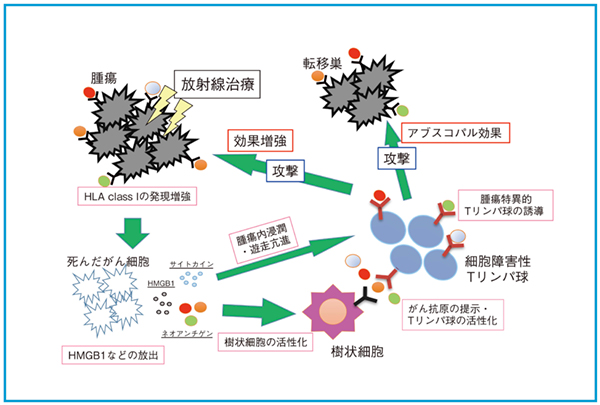
図1 放射線による細胞性免疫増強メカニズム(概略)
放射線照射により,腫瘍のHLA class Iの発現が増強するとともに,死んだがん細胞からHMGB1などの細胞障害関連分子パターンやがん抗原が放出される。次いで,活性化された樹状細胞が,がん抗原を吸収しTリンパ球に提示することで,がん抗原特異的な細胞障害性Tリンパ球が増加する。このTリンパ球が被照射腫瘍を攻撃すれば放射線効果の増強が,照射範囲外の腫瘍を攻撃すればアブスコパル効果が確認される。
免疫放射線治療の現状
放射線治療による抗腫瘍免疫反応の解明が進むが,臨床の現場で,放射線治療による抗腫瘍免疫活性化を介した照射野外の腫瘍縮小,いわゆる「アブスコパル効果」を見ることは非常にまれである。この原因としては,(1) 誘導された抗腫瘍免疫が免疫逃避機構によって阻害されている,(2) 誘導された抗腫瘍免疫が微弱で臨床的に確認できない,などが考えられる。
上述の(1)に注目すると,この免疫逃避機構を解除することで放射線治療の抗腫瘍免疫効果が高まり,アブスコパル効果の頻度も高まる可能性が示唆される。実際に,免疫逃避機構を解除する免疫チェックポイント阻害剤と放射線治療併用の臨床データを見ると,Grimaldiらが,抗CTLA-4抗体治療後に放射線治療を受けた転移を有する進行メラノーマ患者群において,52%(21例中11例)でアブスコパル効果を認めたと報告している6)。さらに,Gomesらの報告でも,抗PD-1抗体治療後に腫瘍増大を認めた患者に対し放射線治療を併用したところ,18%でアブスコパル効果が確認された7)。2017年には,III期非小細胞肺癌患者に対し,根治的化学放射線治療後に抗PD-L1抗体(デュルバルマブ)を逐次併用することで,無増悪生存期間(中央値)が約3倍に延長した(デュルバルマブ群16.8か月,プラセボ群5.6か月)という結果も報告されている8)。また,抗PD-1抗体治療を受けた患者のうち,過去に放射線治療歴を有する患者群が,そうでない群と比較し有意に予後が良好であったという後ろ向き解析の報告もある9)。
われわれは,上述の(2)に注目した臨床結果も報告している。腹膜播種を伴った胃がん術後再発例で,局所の放射線治療に加え,患者の末梢血から採取したTリンパ球を増殖させ患者に戻す養子免疫療法の併用により,48Gy/24回という予防照射程度の線量で,被照射腫瘍の完全消失と腹膜播種巣のアブスコパル効果を認めた症例を経験した10)。このように,臨床レベルにおいても,免疫放射線治療による良好な成績が相次いで報告されている。
免疫放射線治療の今後
今後,世界中で進行中の免疫放射線治療に関する臨床試験の結果が続々と報告される予定である。われわれも,福島県立医科大学附属病院において,進行・再発胃がんに対する放射線治療と抗PD-1抗体の併用療法に関する臨床試験を2018年3月より開始している(UMIN000031508)。
免疫放射線治療により,局所だけでなく全身的な効果も期待できるようになった。抗腫瘍免疫に対する影響から,放射線治療を“in situ vaccine”ととらえる考え方も広がってきており11),局所治療としての従来の役割に加えて,全身治療としての重要性も高まっていくと考えている。さらに,免疫治療の併用は放射線治療の局所効果向上にも寄与することから,免疫治療の併用を想定した線量や照射範囲の設定など,放射線治療の考え方が基本から変わる可能性がある。免疫放射線治療の確立に向け,最適な併用療法,併用時期,総線量や分割方法など,明らかにすべき課題は山積しており,がん治療のさらなる向上のために,われわれ放射線腫瘍医が果たすべき役割は大きい。
●参考文献
1)Sato, H., et al., PLoS ONE, 9, e108122, 2014.
2)Okonogi, N., et al., Int. J. Radiat. Oncol. Biol. Phys., 102, 601〜608, 2018.
3)Yoshimoto, Y., et al., J. Radiat. Res., 56, 509〜514, 2015.
4)Suzuki, Y., et al., Cancer Res., 72, 3967〜3976, 2012.
5)Ganss, R., et al., Cancer Res., 62, 1462〜1470, 2002.
6)Grimaldi, A.M., Oncoimmunology, 3, e28780, 2014.
7)Ribeiro, G.J., J. Immunother., 39, 367〜372, 2016.
8)Antonia, S.J., et al., N. Engl. J. Med., 377, 1919〜1929, 2017.
9)Shaverdian, N., et al., Lancet Oncol., 18, 895〜903, 2017.
10)Sato, H., et al, Clin. Case Rep., 5, 380〜384, 2017.
11)Formenti, S.C., Demaria, S., J. Natl. Cancer Inst., 105, 256〜265, 2013.
